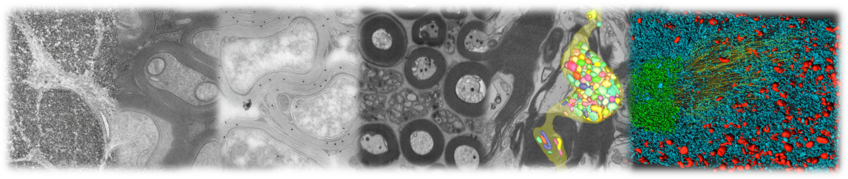
Facility für Elektronenmikroskopie
City-Campus
Unsere Mission
Die Elektronenmikroskopie am City-Campus ist als Facility Teil der Abteilung Neurogenetik (Direktor: Klaus-Armin Nave). Unsere Mission ist Ultrastrukturforschung an biologischen Proben in Kooperation mit Wissenschaftler*innen innerhalb des Max-Planck-Institutes für Multidisziplinäre Naturwissenschaften und dem Göttinger Wissenschaftscampus in Assoziation mit dem Cluster of Excellence "Multiscale Bioimaging: from Molecular Machines to Networks of Excitable Cells" (MBExC).
Was wir bieten
In der Core Facility bieten wir Transmissionselektronenmikroskopie (TEM) zur Analyse der Ultrastruktur in subzellulärer Auflösung an. Darüber hinaus ermöglichen wir die Erzeugung von dreidimensionalen Datensätzen („Volumen-Elektronenmikroskopie“) unter Anwendung von Rasterelektronenmikroskopie mit fokussiertem Ionenstrahl.
Wie wir arbeiten
Wir arbeiten auf Kooperationsbasis mit Wissenschaftler*innen des Institutes zusammen. Dabei beraten wir unsere Partner in Fragen der Probenfixierung oder führen diese selbst durch. Die anschließende Probenpräparation mit Einbettung und Anfertigen der Schnitte wird komplett von unserem Team übernommen. Interessierte Promovierende werden auch gerne darin angeleitet. Die Aufnahme transmissionselektronenmikroskopischer Bilder wird entweder von uns oder den Partnern selbst durchgeführt. Die Datenaufnahme am Rasterelektronenmikroskop erfolgt ausschließlich durch unser Team. Für die anschließende Datenanalyse bieten wir Beratung und Hilfe an.
Pressemitteilungen & Neues aus der Forschung
Austausch von Informationen innerhalb der EM-Community
"Submicron" E-Mail-Liste
Jeder, der im Bereich der Elektronenmikroskopie arbeitet, wird häufig mit Problemen oder Fragen konfrontiert, die im Gespräch mit erfahrenen Kolleginnen und Kollegen gelöst werden könnten. Für diesen Zweck haben wir eine international E-mail-Liste „submicron-list“ gestartet, um einen schnellen Austausch von Informationen zu ermöglichen. Diese Plattform ist ebenfalls ideal um Konferenzen, Workshops oder Stellenausschreibungen bekannt zu geben. Über diese Webpage kann die Liste abonniert werden:
https://listserv.gwdg.de/mailman/listinfo/submicron-l
DGE (German Society of Electron Microscopy) und der Arbeitskreis PANOS
Der Arbeitskreis PANOS (Präparation und Abbildung Nativer Organischer Systeme) der Deutschen Gesellschaft für Elektronenmikroskopie (DGE) wird von den Mitgliedern der DGE organisiert, die im Bereich der biomedizinischen Elektronenmikroskopie arbeiten. Wir organisieren regelmäßige jährliche Frühjahrstreffen, um den Austausch zu fördern und interessante Themen zu diskutieren. Dieses Treffen ist offen für Nicht-Mitglieder der DGE. https://www.dge-homepage.de/
Informationen werden über eine Mailing-Liste ausgetauscht: https://listserv.gwdg.de/mailman/listinfo/panos-list
