Forschung
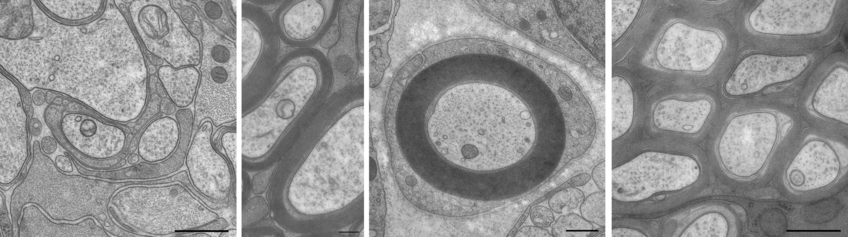
Ein Fokus der Elektronenmikroskopie City-Campus liegt auf der Erforschung von Myelin, einer membranösen vielschichtigen Struktur, die die sogenannte weiße Substanz im Gehirn ausmacht. Myelin wird von Oligodendrozyten im zentralen Nervensystem (ZNS) hergestellt und von Schwannzellen im peripheren Nervensystem (PNS). Die Myelinscheide ist ein Schlüsselelement von langen Axonen, da es die Nervenleitungsgeschwindigkeit auf Grund der saltatorischen Erregungsleitung bis zu 100-fach beschleunigt, verglichen mit nicht-myelinisierten Axonen. Abgesehen davon erfüllt die Myelinscheide Schutz- und Unterstützungsfunktionen für die myelinisierten Axone.
Bei der Erforschung der Biologie und Funktion von myelinisierenden Gliazellen im ZNS fokussieren wir uns auf den Mechanismus der Myelinbiogenese, Aufrechterhaltung und den Umbau. Eine erstaunliche Eigenschaft, die mit Elektronenmikroskopie sichtbar wird, ist das solide und nicht dynamische Erscheinungsbild der Struktur. Außerdem ist bekannt, dass die Myelinproteine sehr langsam umgesetzt werden. Um diesen Mechanismus des Myelinumbaus besser zu verstehen, haben wir induzierbare knock-out Strategie in adultem Alter verwendet und die räumlichen und zeitlichen Veränderungen in der Myelinultrastruktur verfolgt (Meschkat et al, 2022).
Basierend auf der engen Beziehung zwischen der Myelinscheide und dem eingehüllten Axon, auch Axo-Glia-Einheit genannt, können pathologische Veränderungen in den myelinisierenden Gliazellen die axonale Integrität beeinflussen. Im Rahmen der Abteilung Neurogenetik als auch mit Kooperationen auf nationaler und internationaler Ebene erforschen wir pathologische morphologische Veränderungen in unterschiedlichen Myelin Mutanten, um die Funktion von intaktem Myelin, als auch Krankheitsbilder in Leukodystrophien und in Alterungsprozessen besser zu verstehen. Die Beeinträchtigung der Myelinscheide und die Konsequenzen daraus werden in demyelinisierenden Krankheitsmodellen wie Multipler Sklerose (van den Bosch et al, 2023) und Neuromyelitis Optica (Weil et al., 2016 und 2017, Winkler et al., 2021) untersucht, oder auch in Modellen von Erbkrankheiten mit gestörter Myelinbildung wie der Spastischen Paraplegie Typ 2 (Steyer et al., 2020 und 2023).
Abgesehen von Mausmodellen menschlicher Erkrankungen sind wir auch daran interessiert, die evolutionären Aspekte der Myelinentwicklung zu verstehen. Um Fragen in der Myelinevolution zu thematisieren, haben wir eine kieferlose Modellspezies, das Meeresneunauge Petromyzon marinus, ausgewählt, welches kein Myelin bildet, aber mögliche Hinweise gibt durch Parallelen zu Vorfahren vor der Entstehung von Myelin in der Evolution der Vertebraten (Weil et al., 2018). Zudem schauen wir uns die Myelinbildung in anderen Spezies an, wie z.B. im kleinen Rochen (Leucoraja erinacea) (Möbius et al., 2021).
Referenzen:
Meschkat M, Steyer AM, Weil MT, Kusch K, Jahn O, Piepkorn L, Agüi-Gonzalez P, Phan NTN, Ruhwedel T, Sadowski B, Rizzoli SO, Werner HB, Ehrenreich H, Nave KA, Möbius W. (2022) White matter integrity in mice requires continuous myelin synthesis at the inner tongue. Nat Commun. 2022 Mar 4;13(1):1163. doi: 10.1038/s41467-022-28720-y. PMID: 35246535
Möbius W, Hümmert S, Ruhwedel T, Kuzirian A, Gould R. (2021) New Species Can Broaden Myelin Research: Suitability of Little Skate, Leucoraja erinacea. Life (Basel). 2021 Feb 11;11(2):136. doi:10.3390/life11020136. PMID: 33670172
Steyer AM, Buscham TJ, Lorenz C, Hümmert S, Eichel-Vogel MA, Schadt LC, Edgar JM, Köster S, Möbius W, Nave KA, Werner HB. (2023) Focused ion beam-scanning electron microscopy links pathological myelin outfoldings to axonal changes in mice lacking Plp1 or Mag. Glia. 2023 Mar;71(3):509-523. doi: 10.1002/glia.24290. Epub 2022 Nov 10. PMID: 36354016
Steyer AM, Ruhwedel T, Nardis C, Werner HB, Nave K-A, Möbius W. (2020): Pathology of myelinated axons in the PLP-deficient mouse model of spastic paraplegia type 2 revealed by volume imaging using focused ion beam-scanning electron microscopy. J Struc Biol, 2020 May 1;210(2):107492. doi: 10.1016/j.jsb.2020.107492.
van den Bosch A, Hümmert S, Steyer AM, Ruhwedel T, Hamann J, Smolders J, Nave KA, Stadelmann C, Maarten K, Möbius W, Huitinga I. Ultrastructural axon-myelin unit alterations in MS correlate with inflammation. Ann Neurol 2023;93:856–870. doi.org/10.1002/ana.26585 PMID: 36565265
Weil M-T, Heibeck S, Töpperwien M, tom Dieck S, Ruhwedel T, Salditt T, Rodicio MC, Morgan JR, Nave K-A, Möbius W and Werner HB. (2018) Axonal Ensheathment in the Nervous System of Lamprey: Implications for the Evolution of Myelinating Glia. Journal of Neuroscience 18 July 2018, 38 (29) 6586-6596 doi: 10.1523/JNEUROSCI.1034-18.2018. Epub 2018 Jun 25. PMID: 29941446
Weil M-T, Möbius W, Winkler A, Ruhwedel T, Wrzos C, Romanelli E, Bennett JL, Enz L, Goebels N, Nave KA, Kerschensteiner M, Schaeren-Wiemers N, Stadelmann C, Simons M. (2016) Loss of Myelin Basic Protein Function Triggers Myelin Breakdown in Models of Demyelinating Diseases. Cell Rep. Jul 12;16(2):314-22. doi: 10.1016/j.celrep.2016.06.008. Epub 2016 Jun 23. PMID: 27346352
Weil, M-T, Ruhwedel, T, Möbius W, and Simons, M. (2017) Intracerebral injections and ultrastructural analysis of high-pressure frozen brain tissue. Curr. Protoc. Neurosci. 78:2.27.1-2.27.18. doi: 10.1002/cpns.22. PMID: 28046202
Winkler A, Wrzos C, Haberl M, Weil MT, Gao M, Möbius W, Odoardi F, Thal DR, Chang M, Opdenakker G, Bennett JL, Nessler S, Stadelmann C. (2021) Blood-brain barrier resealing in neuromyelitis optica occurs independently of astrocyte regeneration. J Clin Invest. 2021 Mar 1;131(5):e141694. doi: 10.1172/JCI141694. PMID: 33645550