Wie ein Keil im Scharnier
Forscher legen Grundlage, um Wirkstoffe gegen neuen Angriffspunkt in der Krebstherapie maßzuschneidern
Viele Krebsarten sind dank medizinischer Fortschritte inzwischen gut behandelbar. Ein Allheilmittel gegen Krebs ist jedoch nach wie vor in weiter Ferne. Bei manchen Erkrankungen stoßen die verfügbaren Therapien an ihre Grenzen, weil der Tumor von vornherein nicht auf die Behandlung anspricht oder nach einiger Zeit Resistenzen ausbildet. Wissenschaftler forschen daher unter anderem daran, wie sich Krebszellen an Stellen treffen lassen, die bisher kein Ziel von Wirkstoffen sind.
Ein solcher, klinisch noch weitgehend unerprobter Ansatzpunkt ist der Proteinkomplex SF3B. Er ist entscheidend an den ersten Schritten der Herstellung von Proteinen beteiligt, den universellen Werkzeugen lebender Zellen. Damit eine Zelle Proteine produzieren kann, muss sie zunächst deren Bauanleitungen in eine lesbare Form bringen. Dafür werden die Bauanleitungen von einer molekularen Maschine, dem Spleißosom, in einem komplizierten Prozess zerschnitten und neu zusammengesetzt. SF3B steuert hierbei als Teil des Spleißosoms, an welcher Stelle die Bauanleitungen geschnitten werden. Kommt es dabei zu Fehlern, produziert die Zelle veränderte Proteine, die die zellulären Abläufe massiv stören können.
Die Abbildung in Druckauflösung finden Sie hier.
Die Idee der Forscher: Sie wollen die Funktion von SF3B manipulieren und so die Produktion bestimmter Proteine durcheinanderbringen, um Krebszellen zu töten. Dafür konnten sie bereits Wirkstoffe entwickeln, die an SF3B binden. Die Substanzen schalten SF3B allerdings nicht komplett aus, sondern modulieren lediglich dessen Funktion. Das führt dazu, dass einige Protein-Bauaunleitungen anders geschnitten werden. Diese Veränderungen treffen Krebszellen stärker als gesunde Zellen.
„Leider wissen wir bisher jedoch fast nichts darüber, wie genau diese Wirkstoffe mit SF3B in Kontakt treten und dessen Funktion beeinflussen“, sagt Vlad Pena, der am MPI für biophysikalische Chemie die Forschungsgruppe Makromolekulare Kristallografie leitet. „Diese Informationen sind aber wesentlich, um die Wirkstoffe so weit zu verbessern, dass sie als Krebsmedikamente infrage kommen.“
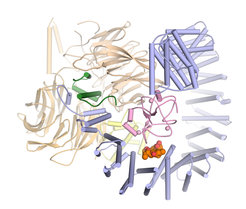
Penas Team ist nun in Zusammenarbeit mit dem Pharmaunternehmen H3 Biomedicine ein entscheidender Schritt gelungen: „Wir konnten zum ersten Mal die dreidimensionale Struktur von SF3B in Wechselwirkung mit einem Wirkstoff in atomarer Auflösung bestimmen,“ erläutert der Strukturbiologe.
Wertvolle Erkenntnisse für Wirkstoffoptimierung
Die Ergebnisse der Wissenschaftler enthüllen im Detail, wie sich der Wirkstoff namens Pladienolid B an SF3B anlagert und dessen Funktion stört. „Pladienolid B wirkt wie ein Keil in einem Scharnier und verhindert, dass sich SF3B zusammenklappen kann. Diese Bewegung ist aber notwendig, damit SF3B zuverlässig funktioniert“, erklärt Constantin Cretu aus Penas Team und Erstautor der jetzt im Fachjournal Molecular Cell erschienenen Arbeit.
Die neuen Erkenntnisse erklären frühere Ergebnisse zu ähnlichen Wirkstoffen, denn Pladienolid B steht in der Arbeit der Strukturbiologen stellvertretend für eine ganze Klasse an chemischen Verbindungen, die in ihrer Gestalt stark variieren, aber eine wichtige Gemeinsamkeit haben: In ihrem Zentrum besitzen sie alle die gleiche chemische Gruppe. „Bisher war unklar, warum diese chemische Gruppe so wichtig ist,“ berichtet Cretu. „Unsere Struktur von SF3B und Pladienolid B zeigt nun, dass genau diese Gruppe wesentlich dazu beiträgt, dass der Wirkstoff direkt ans SF3B binden kann.“
Darüber hinaus kartieren die Daten der Forscher alle weiteren Kontakte zwischen Pladienolid B und SF3B. Anhand dieser Informationen lässt sich voraussagen, an welchen Stellen der Wirkstoff verändert werden kann und an welchen nicht. „Wir hoffen, dass unsere Erkenntnisse eine Richtschnur sind, anhand derer sich neue Krebswirkstoffe entwickeln lassen“, so Pena. (fk)












