Ein Türöffner für den Selbstmord von Zellen
Forscher zeigen, wie das Protein Bax die Entscheidung der Zelle, zu sterben, unwiderruflich macht.
(The EMBO Journal, 18. Januar 2016)
Wenn Körperzellen sich selbst töten, geschieht das aus gutem Grund: Beschädigte oder krankhaft veränderte Zellen stellen eine Gefahr für den Organismus dar. Durch ihren Tod kann er sich vor neurodegenerativen Erkrankungen, Autoimmunkrankheiten und Krebs schützen. Auch ein Embryo kann sich nur gesund entwickeln, wenn Zellen nach dem Erfüllen ihrer Aufgabe absterben. Dieser zelluläre Selbstmord ist Zellen fest eingespeichert und läuft nach einem strikten Programm ab. Eine zentrale Rolle spielen dabei Mitochondrien, die die Zelle mit Energie versorgen. Leitet eine Zelle die Apoptose ein, entstehen Löcher in der Hüllmembran der Mitochondrien. Dadurch gelangen bestimmte Proteine aus ihrem Inneren in das umgebende Zellplasma. Dort setzen sie eine Kettenreaktion in Gang, die die Zelle unweigerlich tötet.

Zwar weiß man inzwischen, welche Faktoren daran beteiligt sind, die Mitochondrienmembran porös zu machen. Wie dies genau geschieht, war bisher jedoch weitgehend unklar. Ein Göttinger Wissenschaftlerteam um Stefan Jakobs am Max-Planck-Institut (MPI) für biophysikalische Chemie und an der Universitätsmedizin Göttingen hat nun herausgefunden, dass sich das Protein Bax auf den Mitochondrien zu Ringen organisiert und so dazu beiträgt, die Membran zu öffnen.
Solange die Zelle gesund ist, befinden sich die Bax-Proteine meist im Zellplasma. Doch wenn die Apoptose beginnt, ändern sie ihre molekulare Form und konzentrieren sich in großer Zahl auf der Mitochondrienmembran. „Bisherige mikroskopische Aufnahmen zeigten, dass Bax-Proteine große Ansammlungen bilden, die sich in der Membran verankern“, erläutert Stefan Jakobs. „Doch unbeantwortet war bisher die Frage: Welche Funktion haben die Ansammlungen?“ Es gab lediglich eine Vermutung: Bax könnte sich gewissermaßen als „Kanalarbeiter“ in der Mitochondrienmembran betätigen und Löcher schaffen, durch die die Apoptose-Proteine ins Zellplasma gelangen. „Allerdings hat bisher nie jemand entsprechende Anordnungen von Bax in Zellen gefunden“, so Jakobs.
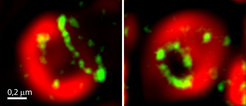
Mithilfe der ultrahochauflösenden STED-Mikroskopie ist es Jakobs‘ Team nun gelungen, die Bax-Proteine mit bislang unerreichter Detailschärfe zu untersuchen. „Auf unseren hochaufgelösten Aufnahmen ist deutlich zu erkennen, dass die Bax-Ansammlungen in Wahrheit häufig Ringe unterschiedlicher Größe sind“, berichtet Daniel Jans, Wissenschaftler im Team von Jakobs. Weitere ausgeklügelte Experimente offenbarten ein anderes wichtiges Detail: „Normalerweise ist die äußere Mitochondrienmembran dicht bepackt mit zahlreichen Proteinen. Im Inneren der Bax-Ringe fehlen diese Proteine aber. Das deutet darauf hin, dass die Ringe die Membran verdrängen, also innen hohl sind – wie Kanäle.“
Die Wissenschaftler zeigen damit erstmals, dass Bax-Proteine in der Tat Poren in der Membran der Mitochondrien bilden könnten. Die neuen Erkenntnisse liefern einen wichtigen Beitrag, um die mechanistischen Einzelheiten der Apoptose besser zu verstehen. (fk)












