Chemischer Reaktionsmechanismus der Umwandlung von Kohlenmonoxid zu Kohlendioxid geklärt
Katalysatoren in modernen Autos oder Industrieschornsteinen sorgen für sauberere Luft: Sie wandeln giftige Abgase, die bei Verbrennungsreaktionen entstehen, in für Mensch und Umwelt unschädlichere Stoffe um. Eine der wichtigsten Katalysen ist dabei die Reaktion von toxischem Kohlenmonoxid zum weniger schädlichen Kohlendioxid an einer Platin-Oberfläche. Ein internationales Team am Max-Planck-Institut (MPI) für biophysikalische Chemie und der Universität Göttingen hat nun aufgeklärt, was bei dieser Umwandlungsreaktion im molekularen Detail passiert. Die Erkenntnisse können dabei helfen, bessere Katalysatoren zu entwickeln.
(Nature, 14. Juni 2018)
Katalysatoren sind aus der Chemietechnik nicht wegzudenken: Der Großteil aller chemischen Erzeugnisse durchläuft während seiner Entstehung zumindest eine katalytische Reaktion. Als Katalysatoren bezeichnet man solche Stoffe, die die Geschwindigkeit einer chemischen Reaktion erhöhen, ohne dabei selbst verändert oder verbraucht zu werden. Das ist möglich, weil sie den Reaktionsmechanismus modifizieren. Eine klassische Modellreaktion in der Katalyse- und Oberflächenchemie ist die Reaktion von Kohlenmonoxid mit Sauerstoff zu Kohlendioxid, eine sogenannte Oxidation. In den letzten 40 Jahren wurden zahlreiche Phänomene an dieser Reaktion erforscht – unter anderem der Einfluss der Ausgangsstoffe und äußerer Parameter wie Temperatur oder Druck.
„Die Oxidation von Kohlenmonoxid zu Kohlendioxid ist eine der ältesten und am besten untersuchten katalytischen Reaktionen überhaupt. Doch bislang hatten Wissenschaftler nicht die technischen Möglichkeiten, auf molekularer Ebene zu analysieren, was genau mit den einzelnen Molekülen bei dieser Reaktion passiert“, erklärt Theofanis Kitsopoulos, Leiter der jetzt im renommierten Journal Nature erschienenen Arbeit. Kitsopoulos, Projektgruppenleiter am Göttinger MPI für biophysikalische Chemie sowie Professor an der Universität Kreta und dem Institute of Electronic Structure and Laser FORTH (beide in Iraklio, Griechenland), berichtet: „Uns ist es jetzt gelungen, diesen chemischen Reaktionsmechanismus im Detail zu entschlüsseln.“
Was geschieht bei der Reaktion?
Die Umwandlung des toxischen Kohlenmonoxids in das weniger schädliche Kohlendioxid erfolgt an einer Platin-Oberfläche, die die Reaktion katalysiert. Dafür binden zunächst Sauerstoff- und Kohlenmonoxid-Moleküle an die Oberfläche des Platins, bevor sie zu Kohlendioxid reagieren und sich gleichzeitig wieder vom Platin lösen, das dabei unverändert bleibt.
Die Reaktion wird dadurch kompliziert, dass die Oberfläche des Platins auf atomarer Ebene nicht gleichmäßig ist. Etwa 99 Prozent der Platin-Oberfläche besteht aus glatten Flächen, während gut ein Prozent Stufen zwischen den einzelnen glatten Schichten der Platin-Atome ausmachen. Beide Oberflächentypen sind katalytisch aktiv, wobei die Stufen mehr katalytische Aktivität aufweisen als die glatten Flächen. Darüber hinaus entstehen bei der Reaktion zwei verschiedene Spezies an Kohlendioxid-Molekülen: Die einen sind hyperthermisch, besitzen also hohe Energien und Geschwindigkeiten, die anderen sind thermisch, mit mäßigen Energien und Geschwindigkeiten.
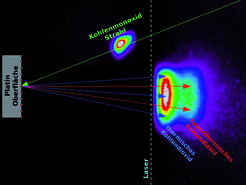
Doch wie beeinflussen die beiden verschieden aktiven Oberflächen des Platins die Katalyse? Und wie kommt es bei der Reaktion zu zwei Produkten mit unterschiedlichen physikalischen Eigenschaften? Um diese Fragen zu klären, kombinierte das Forscherteam um Kitsopoulos in einem innovativen Ansatz zwei Methoden, die bisher nicht zusammen verwendet wurden: Die Wissenschaftler nutzten einen Strahl aus gasförmigen Kohlenmonoxid-Molekülen, mit dem sie gezielt und zu definierten Zeitpunkten eine Platin-Oberfläche beschossen, an die bereits molekularer Sauerstoff gebunden war. Mithilfe der sogenannten slice-ion imaging-Methode bestimmten die Forscher dann den genauen Ort der Reaktion sowie die Geschwindigkeit und den Winkel, in dem die entstandenen Kohlendioxid-Moleküle von der Platin-Oberfläche wegflogen.
„Unsere Untersuchungen zeigen, dass es drei verschiedene Reaktionsmechanismen gibt: Zwei davon führen zur Produktion von thermischem Kohlendioxid und dominieren bei Temperaturen unterhalb 700 Kelvin, also etwa 427 Grad Celsius. Bei diesen Reaktionswegen wandert das Kohlenmonoxid entweder von glatten Flächen zu Stufen auf der Platin-Oberfläche und reagiert dort mit einem Sauerstoff-Atom. Oder Kohlenmonoxid, das bereits an einer Platin-Stufe hängt, reagiert direkt mit Sauerstoff. Beim dritten Mechanismus, der bei höheren Temperaturen überwiegt, reagieren Kohlenmonoxid und Sauerstoff auf glatten Flächen zu hyperthermischem Kohlendioxid“, fasst Jannis Neugebohren, Doktorand am Institut für Physikalische Chemie der Universität Göttingen und Erstautor der Arbeit, die Forschungsergebnisse zusammen.
Alec Wodtke, Direktor am MPI für biophysikalische Chemie und Professor an der Universität Göttingen, ist vom Potenzial der innovativen Methode zur Erforschung chemischer Reaktionen überzeugt: „Diese Strategie können wir nun auch auf andere heterogene Oberflächenreaktionen anwenden. So haben wir die Möglichkeit, völlig neue Einblicke in die Rolle verschiedener, katalytisch aktiver Zentren zu gewinnen. Diese Erkenntnisse können uns unter anderem dabei helfen, bessere Katalysatoren zu entwickeln.“ (ad)
Gemeinsame Pressemitteilung des MPI für biophysikalische Chemie
und der Universität Göttingen












