Elektrophysiologie in atomarer Auflösung
Die Patch-Clamp-Technik hat die elektrophysiologische Forschung revolutioniert und ist Standard in Laboren weltweit. Damit können Forschende den Ionenstrom durch einen einzigen Ionenkanal genau messen. Was im Inneren eines Kanals passiert, lässt sich jedoch nicht beobachten. Ein Forschungsteam um Bert de Groot hat jetzt mithilfe von Molekulardynamik-Simulationen erstmals in atomarer Auflösung sichtbar gemacht, wie Kaliumionen einen Kaliumionenkanal passieren. Die dabei zugrunde gelegten Berechnungen stimmten präzise mit den Patch-Clamp-Messungen überein. Die Simulationen könnten dazu beitragen, besser zu verstehen, wie Ionenkanäle reguliert werden oder Medikamente auf Ionenkanäle wirken.
Forschende berechnen erstmals mithilfe von Molekulardynamik-Simulationen präzise den elektrischen Strom, der durch einen Ionenkanal fließt, und machen sichtbar, wie Kaliumionen einen Kaliumkanal passieren.
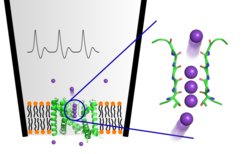
Bis zu vier Kaliumionen sind beim Durchqueren des Kaliumkanals wie auf einer Perlenschnur direkt aneinandergereiht und nicht, wie bisher postuliert, durch Wassermoleküle getrennt.
Die Anordnung der Ionen ist sowohl die Grundlage für den effizienten Ionenfluss durch den Kanal als auch für dessen strikte Selektivität für Kalium.
Sie sind buchstäblich Kanäle für Kommunikation: Poren bildende Proteine in lebenden Zellen, auch Ionenkanäle genannt, sind in die äußere Membran fast aller Zelltypen eingelagert und spielen eine entscheidende Rolle in den verschiedenen Nachrichtensystemen in unserem Körper. Blut-, Immun- oder Leberzellen kommunizieren darüber. Nervenzellen leiten über Ionenkanäle elektrische Signale an andere Zellen weiter.
Mit der von den Göttinger Forschern Erwin Neher und Bert Sakmann 1976 am damaligen Max-Planck-Institut (MPI) für biophysikalische Chemie (heute: MPI für Multidisziplinäre Naturwissenschaften) entwickelten Patch-Clamp-Technik ließ sich erstmals der extrem schwache elektrische Strom durch einen einzelnen geöffneten Ionenkanal in einer Nervenzelle messen. Im Jahr 1991 erhielten Neher und Sakmann dafür den Nobelpreis für Physiologie oder Medizin.
Experimentelle Messung Atom für Atom nachgeahmt
Patch-Clamp-Messungen sind sehr genau. Sie liefern aber keine detaillierten Informationen darüber, wie Ionen einen Kanal passieren, welche Wechselwirkungen sie dabei mit anderen Ionen und Molekülen eingehen und was Ionenkanäle für eine bestimmte Ionenart so effizient und selektiv macht. „Molekulardynamik-Simulationen können den experimentellen Aufbau Atom für Atom nachahmen und so Aufschlüsse über Vorgänge geben, die wir nicht experimentell beobachten können“, erklärt Bert de Groot, Forschungsgruppenleiter am MPI für Multidisziplinäre Naturwissenschaften. Die Kontrolle dafür, dass diese Simulationen korrekt sind, ist, dass sie präzise mit den durch die Patch-Clamp-Methode gemessenen Ionenströmen übereinstimmen müssen. Und genau hier hakte es in bisher durchgeführten Simulationen: Sie stimmten nicht genau mit den experimentell gemessenen Strömen überein.
Fast 50 Jahre nach Entwicklung der Patch-Clamp-Technik gelang es dem Team um de Groot in Kooperation mit Forschenden an der Queen Mary University London (Großbritannien) die experimentell gemessenen Ströme durch Ionenkanäle präzise zu berechnen. Mithilfe von atomistischen Molekulardynamik-Simulationen, bei denen die sogenannte effektive elektronische Polarisation mit einbezogen wurde, konnte das Forschungsteam die Genauigkeit dieser Berechnungen deutlich verbessern.
Grundlage für Selektivität
Den Forschenden gelang es mit diesen verbesserten Berechnungen zum ersten Mal, realistisch abzubilden, wie Kaliumionen einen Kaliumkanal passieren und wie anderen Ionen der Zutritt erfolgreich verwehrt wird. Wie genau die Passage der Ionen durch den Kanal erfolgt, war bislang umstritten. Während frühere Daten darauf hindeuteten, dass die einzelnen Kaliumionen durch Wassermoleküle im Kanal getrennt werden, lassen die aktuellen Ergebnisse von de Groots Team darauf schließen, dass sich bis zu vier Kaliumionen beim Durchqueren des Kaliumkanals wie auf einer Perlenschnur aneinanderreihen.
„Das ist überraschend, denn die Ionen müssten sich aufgrund ihrer positiven Ladung eigentlich gegenseitig abstoßen“, erklärt Chenggong Hui, Erstautor der jetzt im wissenschaftlichen Fachmagazin PNAS erschienenen Studie. „Diese höchst ungewöhnliche Anordnung ist sowohl die Grundlage für den effizienten Ionenfluss als auch für die strikte Selektivität des Ionenkanals für Kalium. Sie verhindert auch, dass kleinere Ionen wie Natrium den Kanal durchqueren“, so Hui. Da Ionenkanäle wichtige Angriffspunkte für Medikamente sind, sei ein Verständnis ihrer Funktion von großer Bedeutung für die Pharmaforschung. (cr)











