Über die Forschung von Stefan Hell
Nobelpreis für Chemie 2014

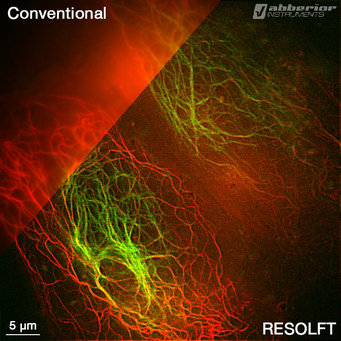
Mit seiner Erfindung der STED (Stimulated Emission Depletion)-Mikroskopie, die er 1999 experimentell realisierte, hat Stefan Hell die Lichtmikroskopie revolutioniert. Herkömmliche Lichtmikroskope haben eine Auflösungsgrenze, die durch die Wellennatur des Lichts bedingt ist: Objekte, die weniger als 200 Nanometer (millionstel Millimeter) voneinander entfernt sind, können nicht mehr getrennt wahrgenommen werden. Die von Ernst Abbe entdeckte Auflösungsgrenze – in einer Jenaer Gedenkstätte in Stein gemeißelt – galt für mehr als ein Jahrhundert für praktisch unumstößlich. Auch die häufig in der Biologie und Medizin eingesetzte Fluoreszenzmikroskopie musste bisher vor dieser Grenze halt machen. Dabei werden Moleküle der Zelle mit fluoreszierenden Farbstoffen markiert und mit Laserlicht einer bestimmten Wellenlänge gezielt „angeschaltet“, sodass sie leuchten. Liegen die Moleküle enger beieinander als 200 Nanometer, verschwimmen sie allerdings auch hier zu einem verwaschenen Fleck. Für Biologen und Mediziner bedeutete dies eine massive Einschränkung – denn für sie sind weitaus kleinere Strukturen in lebenden Zellen interessant.
Stefan Hell hat als Erster einen Weg gefunden, die Abbesche Auflösungsgrenze von Lichtmikroskopen radikal zu unterlaufen – mit einem völlig neuen Konzept. Bei der von ihm erfundenen und zur Anwendungsreife entwickelten STED-Mikroskopie ist die Auflösung nicht länger durch die Lichtwellenlänge begrenzt. Dadurch ist es erstmals möglich, Strukturen in einer Zelle mit einer heute bis zu zehnmal besseren Detailschärfe im Vergleich zu herkömmlichen Fluoreszenzmikroskopen zu beobachten.
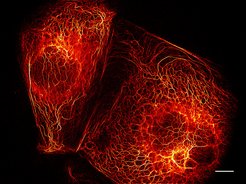
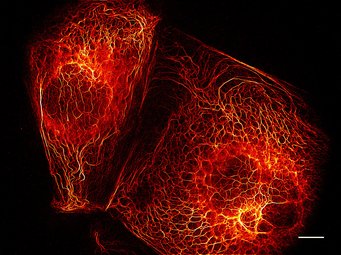
Parallelisierte RESOLFT-Nanoskopie erlaubt sekundenschnelles Abbilden lebender Zellen. Das Bild zeigt das Stützprotein Keratin in Krebszellen. Es basiert auf 144 Einzelaufnahmen, die gesamte Aufnahmedauer liegt in der Größenordnung einer Sekunde. Maßstab: 10 μm.
Er und sein Team wenden mit dem STED-Mikroskop einen Trick an, um dem Phänomen der Lichtbeugung ein Schnippchen zu schlagen. Hierbei wird einem Strahl, der die Fluoreszenzmoleküle anregt, ein zweiter Lichtstrahl, der STED-Strahl, hinterhergesandt. Dieser bewirkt genau das Gegenteil: Er regt die Moleküle sofort ab und hält sie so dunkel. Damit der STED-Strahl aber nicht alle Moleküle abschaltet, hat er in der Mitte ein Loch. Dadurch werden Moleküle am Rand des Anregungs-Lichtflecks dunkel, wohingegen Moleküle im Zentrum ungestört leuchten können. Die Helligkeit des STED-Strahls kann so eingestellt werden, dass die Ausdehnung des Bereichs, in dem die Moleküle fluoreszieren können, beliebig verringert werden kann. Mit einem gegenüber dem klassischen Fokus typischerweise um einen Faktor zehn verengten fluoreszierenden Bereich wird die Probe abgerastert und somit ein Bild erstellt.
Doch nicht nur Momentaufnahmen sind mit dem neuen STED-Mikroskop möglich. Sogar Lebensvorgänge im Inneren lebender Zellen lassen sich damit „live“ mit Nanometer-Auflösung verfolgen. So gelang es dem Team um Hell, erstmals die Bewegungen von Botenstoff-Bläschen in einer Nervenzelle in Echtzeit zu „filmen“ – mit 33 Bildern pro Sekunde und einer Auflösung von rund 70 Nanometern.
Mit seinen bahnbrechenden Arbeiten zu STED und weiteren damit verwandten Verfahren wie der 4Pi-Mikroskopie hat Stefan Hell in den vergangenen Jahren ein Fenster aufgestoßen, um weit in den Nanokosmos lebender Zellen vorzudringen. In der Erforschung von Krankheiten oder der Entwicklung von Medikamenten biete die STED-Mikroskopie reichlich Potenzial.