Maß genommen: Architektur von Muskelkomponenten der Fliege mithilfe von Nanobodies bestimmt
Ob Mensch oder Fliege: Muskeln sind unverzichtbar, damit sich ein Lebewesen bewegen oder das Blut in dessen Körper transportiert werden kann. Die kleinste krafterzeugende Einheit in allen Muskeln ist das Sarkomer. Seine Länge ist in Säugetieren genau festgelegt. Ein internationales Forschungsteam hat jetzt nachgewiesen, dass dieses Prinzip auch für die Insektenwelt gilt: Die Länge von Sarkomeren ist in der Fliege auf ganz ähnliche Weise definiert.
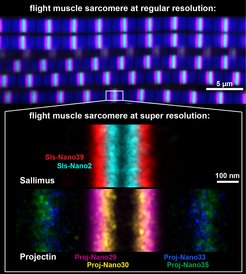
Das untere Bild ist eine Collage von Sarkomeren von Flugmuskeln, die mit Nanobodies und DNA-PAINT in Superauflösung abgebildet wurden. Die Enden einer kurzen Version des Titin-Homologs Sallimus sind in cyan (Sls-Anfang) und rot (Sls-Ende) markiert, während Projectin in magenta und gelb (Proj-Anfang) sowie in blau und grün (Proj-Ende) gefärbt sind. Jede Farbe repräsentiert einen spezifischen Nanokörper, der gegen einen kleinen Teil der großen Proteine erzeugt wurde. Beachtenswert ist die Überlagerung der Positionen der beiden Titin-Proteine. Der Maßstab beträgt 100 nm.
Das Sarkomer besteht aus drei Schlüsselproteinen: Aktin, Myosin und Titin. Während Aktin lange, parallele Stränge bildet, fungieren Myosin-Proteine als molekulare Motoren, die die Aktin-Stränge zusammenziehen, um das Sarkomer zu kontrahieren. Titin, ein Gigant im Reich der Proteine, durchspannt das Sarkomer und verbindet die Aktin- und Myosin-Proteine mechanisch miteinander. Als eine molekulare Expanderfeder sorgt Titin nicht nur für die nötige Elastizität der Muskulatur, sondern definiert auch die Länge der Sarkomere von Säugetieren. Doch gilt dieses Prinzip gleichermaßen für andere Gruppen im Tierreich? Die Gesamtarchitektur der Muskeleinheit ist zwar von der Fliege bis zum Menschen konserviert, aber nicht alle ihre Komponenten sind identisch.
In einer vom Europäischen Forschungsrat finanzierten internationalen Zusammenarbeit haben Frank Schnorrer vom Institut für Entwicklungsbiologie in Marseille (Frankreich), Dirk Görlich vom Max-Planck-Institut (MPI) für Multidisziplinäre Naturwissenschaften in Göttingen und Ralf Jungmann vom MPI für Biochemie in München nun die exakte Architektur der Sarkomere von Insekten untersucht. Als Modellorganismus diente ihnen dabei die Fruchtfliege Drosophila melanogaster, die zwei verschiedene Titin-Proteinvarianten namens Sallismus und Projectin enthält.
Mit Nanobodies Maß nehmen
Um die Sarkomer-Bausteine in der Fliege sichtbar zu machen und zu vermessen, entwickelte Görlich mit seiner Abteilung Zelluläre Logistik Miniatur-Versionen von Antikörpern, sogenannte Nanobodies, die mit hoher Spezifität an ausgewählte Bereiche in Sarkomer-Proteinen binden. Mit einem Fluoreszenzfarbstoff gekoppelt leuchten diese unter einem Fluoreszenzmikroskop bunt auf und können so im Sarkomer-Protein genau lokalisiert werden.
Mithilfe von Nanobodies, die spezifisch den Anfang oder das Ende des Sallimus-Proteins erkennen, zeigten Vincent Loreau und sein Kollege Eunice Chan aus Schnorrers Team, dass Fliegenlarven in ihren Muskeln sehr lange Varianten dieses Proteins aufweisen. Diese Varianten waren größer als zwei Mikrometer. Zudem haben sie sehr lange Sarkomere. Flugmuskeln adulter Fliegen, die kurze Sarkomere enthalten, besitzen dagegen nur kurze Sallismus-Versionen. Die Forschenden schließen daraus, dass die Länge der Titin-Proteine die Sarkomere-Länge sowohl in den Muskeln im menschlichen Körper als auch in der Fruchtfliege bestimmen.
Für Schnorrers Gruppe haben die fluoreszenzmarkierten Nanobodies zudem noch einen weiteren Vorteil: Sie lassen sich in den lebenden Muskeln von Fliegen herstellen. Mit diesem Trick konnten sie die Dynamik des Fliegen-Titins Sallimus in larvalen Muskeln untersuchen und fanden heraus, dass es bemerkenswert stabil ist. In das Sarkomer eingebaut, war es nach 30 Minuten immer noch vorhanden.
Um die Positionen der Sarkomer-Proteine genauer zu vermessen, kamen maßgeschneiderte Nanobodies zum Einsatz. Florian Schueder in Jungmanns Team veränderte zusammen mit Kolleg*innen in Marseille und Göttingen die Nanobodies dafür so, dass sie sich für eine superauflösende Mikroskopie Technik namens DNA-PAINT-Mikroskopie einsetzen ließen. Diese Technik ermöglichte es, einzelne Protein-Module in Sarkomeren mit einer Genauigkeit von fünf Nanometern zu lokalisieren.
Damit konnten die Wissenschaftler*innen die exakten Positionen einzelner Module der beiden Titin-Proteine in den Sarkomeren der Flugmuskeln vermessen. Überraschend für die Forschenden überlappte das Ende des kurzen Sallimus-Proteins mit dem Anfang des Projectins. Dies ist interessant, weil es darauf hindeutet, dass die beiden Drosophila-Titin-Proteine nicht nur die Funktion mit dem großen Säugetier-Titin teilen, sondern dass sie wie dort mechanisch verbunden sind.
Das Forschungsteam verspricht sich von der Palette an innovativen Werkzeugen zukünftig neue Perspektiven in der Sarkomer-Forschung. Damit lässt sich die Dynamik, wie das Sarkomer aufgebaut und aufrechterhalten wird, mit einer noch nie dagewesenen Auflösung untersuchen.










