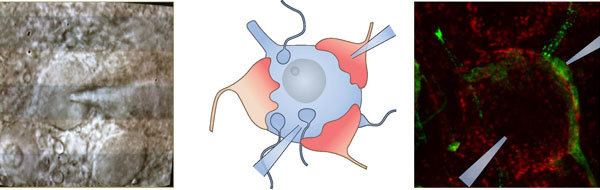
Auditorische Neurowissenschaften & Synaptische Nanophysiologie

Die Arbeitsgruppe Synaptische Nanophysiologie strebt die Entschlüsselung der Mechanismen der synaptischen Transmission an den Synapsen von Haarsinneszellen und den sehr großen calcyx-förmigen Synapsen der zentralen Hörbahn an. Von besonderem Interesse sind die Mechanismen, die eine hohe Zeitauflösung und Zuverlässigkeit an diesen Synapsen der frühen Hörbahn ermöglichen. Wir gehen diese Fragen mit einer systematischen Analyse der molekularen Nanoanatomie und Nanophysiologie von Haarzell-Bändersynapsen und den von Held beschriebenen synaptischen Endkolben in normalen und genetisch manipulierten Tieren an.
Wir führen prä- und postsynaptische patch-clamp Ableitungen durch um die synaptische Transmission mit hoher Auflösung aufzuzeichnen und die Synapse zu manipulieren. Wir nutzen Messungen der präsynaptischen Membrankapazität (whole-cell and cell-attached) um exozytische und endozytische Prozesse direkt zu untersuchen. Die Ca2+ Abhängigkeit der Exozytose studieren wir mit Manipulation des Ca2+ Stroms und Ca2+ Uncaging. Wir untersuchen die molekularen Nanoanatomie und Nanophysiologie mit konfokaler und STED Mikroskopie.
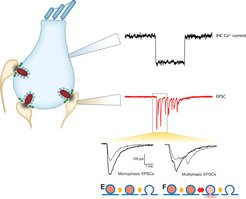
Molekulare Nanoanatomie und Nanophysiologie der Haarzell-Bändersynapse
Schall wird an der Bändersynapse der inneren Haarzellen mit Spiralganglionneuronen kodiert. Unsere Gruppe strebt ein umfassendes Verständnis der synaptischen Transmission an, die durch offenbar stark spezialisierte molekulare Zusammensetzung und Ultrastruktur ermöglicht wird. Wir nutzen hochaufgelöste Patch-clamp Ableitungen der postsynaptischen exzitatorischen Ströme (rot) die auch mit präsynaptischen Messungen von den inneren Haarzellen (IHC, schwarz) kombiniert werden. Wir postulieren, dass die Freisetzung an dieser Synapse überwiegende uniquantal (unabhängige Fusion einzelner Vesikel) ist, die Freisetzung durch eine dynamische Fusionspore reguliert wird, und von dem Ca2+ Einstrom durch einen oder wenige Ca2+ Kanäle in unmittelbarer Nähe (wenige Nanometer) verursacht werden.
Der Fokus unseres funktionellen Imagings liegt bei den Ca2+ Signalen und dem Vesikel-Turnover individueller aktiver Zonen. Das Imaging baut auch auf die Zusammenarbeit mit der Abteilung NanoBiophotonik von Stefan Hell. Wir nutzen die erhobenen morphologischen und funktionellen Daten als Input für unsere biophysikalische Modellierung, die wir in Zusammenarbeit mit Fred Wolf, Arbeitsgruppe Theoretische Neurophysik am MPI für Dynamik und Selbstorganisation durchführen und die uns hilft unsere Hypothesen zu testen und neue Experimente zu planen. Unsere Arbeitsgruppe wird durch die MPG, die Universitätsmedizin Göttingen und die DFG durch den Sonderforschungsbereich SFB 889 und das FZT/EXC Center for Nanoscale Microsopy and Molecular Physiology of the Brain unterstützt.


