Shuttle-Service für Moleküle – Logistik in kleinsten Dimensionen
Lebende Zellen gleichen in vieler Hinsicht Miniatur-Fabriken mit winzigen Produktionsstätten, Förderbändern und Maschinen. Anders als Bakterienzellen, zeichnen sich die komplexer gebauten Zellen von Pilzen, Pflanzen und Tieren dabei durch strikte Arbeitsteilung aus. Sie sind in verschiedene Abteilungen – Kompartimente – gegliedert, von Verpackungs- und Sortierstationen, Proteinfabriken und Kraftwerken bis hin zur Kommandozentrale, dem Zellkern. In diesem ist das gesamte Genom ( Erbgut ) archiviert, das die Baupläne für die Produktion von Proteinen enthält. Die Proteinfabriken allerdings, die nach diesen Bauplänen arbeiten, befinden sich außerhalb des Kerns im sogenannten Zytosol. Wie gelangen die Baupläne in die Proteinfabriken?
"Rushhour" an der Kernhülle
Um dieses logistische Problem zu lösen, muss die Zelle einigen Aufwand betreiben. Dazu werden Kopien der einzelnen Gene in Form von Boten-Ribonukleinsäure (Boten-RNA) erstellt und aus dem Zellkern exportiert. Proteinfabriken – die Ribosomen – verwenden diese dann im Zytosol zur Protein-Herstellung. Die Boten-RNA ist damit ein wahrer Exportschlager. Umgekehrt erfolgt auch ein massiver Import in den Kern. In jeder Minute werden damit mehr als eine Million Moleküle transportiert, darunter viele Proteine. Die Folge ist ein immenser Güterverkehr zwischen Zellkern und Zytosol, der der Rushhour einer Großstadt in nichts nachsteht. So entspricht der Materialstrom, der täglich durch die unzähligen Kernporen eines Menschen geleitet wird, in etwa unserem Körpergewicht.
Shuttle-Service für große Moleküle
Mit einem zehntausendstel Millimeter Durchmesser sind die Kernporen nanoskopisch klein. Selbst im besten Lichtmikroskop ist eine einzelne Kernpore kaum mehr als ein winziger Punkt. Kernporen arbeiten als hochselektive Tore und Sortieranlagen: Während sie die meisten kleinen Moleküle ungehindert passieren lassen, verweigern sie sperrigem Material den Durchtritt. Können sich große Moleküle allerdings durch einen "Passierschein" ausweisen, dann übernehmen Shuttle-Moleküle (sogenannte "Exportine" oder "Importine") deren Transport. Anders als ihre Fracht haben diese Shuttle das Privileg, die Kernporen nahezu ungehindert zu passieren.
"Be- und Entladung dieser Transporter steuert ein molekularer Schalter namens "Ran". Das kleine Molekül "GTP" schaltet Ran im Zellkern gewissermaßen "an". Exportine erhalten von RanGTP das Zeichen zum Laden, Importine das Signal zum Entladen ihrer Fracht", erklärt Ralf Ficner, Leiter der Abteilung Molekulare Strukturbiologie an der Universität Göttingen. Doch wie setzt RanGTP die Fracht-Beladung von Exportinen in Gang? Und wie erkennt und liest ein Exportin den "Passierschein" seines Frachtgutes? Exportin 1 (auch bekannt als CRM1) ist ein wahrer Allrounder unter den Transportern. Es exportiert hunderte, vielleicht tausende verschiedene Zell-Bestandteile aus dem Kern, angefangen bei RNA und Proteinen bis hin zu ganzen Ribosomen. Nicht zuletzt bedienen sich auch einige Viren wie das HIV dieses Transportweges. "Eine solche Vielfalt an Passierscheinen zu lesen, ist ein wahrer Spagat für das Allround-Shuttle. Es soll keine Fracht übersehen, aber auch keine 'blinden Passagiere' an Bord nehmen", so Dirk Görlich, Leiter der Abteilung Zelluläre Logistik am Max-Planck-Institut für biophysikalische Chemie.
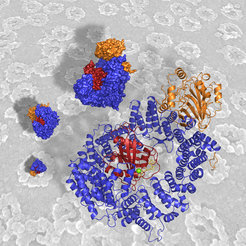
Transportkomplex in atomarer Auflösung
Einen wichtigen Teil dieses Rätsels haben die Göttinger Wissenschaftler um Ficner und Görlich jetzt gelöst. Den Nachwuchswissenschaftlern Thomas Güttler und Thomas Monecke gelang es, die entscheidende experimentelle Hürde zu meistern, an der sich Wissenschaftler seit über zehn Jahren versuchen: Sie konnten CRM1 im Komplex mit dem molekularen Schalter RanGTP und einem Frachtmolekül namens Snurportin kristallisieren. Mithilfe der Röntgenstrukturanalyse lässt sich damit der Transportkomplex wie unter einer Art Supermikroskop in atomarem Detail untersuchen.
"Wir sehen jetzt, dass Schalter und Frachtmolekül an völlig unterschiedlichen Stellen von CRM1 sitzen - die beiden sehen sich praktisch nicht. RanGTP scheint bei Bindung an CRM1 wichtige Strukturänderungen im Shuttle auszulösen", erklärt Thomas Monecke. Erst diese Strukturänderungen befähigen den Transporter, seine Fracht zu laden. Wie die Forscher herausfanden, erkennt und bindet CRM1 Snurportin gleich mehrfach - über drei unterschiedliche Stellen seiner großen Oberfläche. "Dass CRM1 Fracht über seine Außenseite bindet, könnte auch der entscheidende Trick sein, der dieses Exportin zum wahren Transport-Allrounder macht. Denn Transporter, die auf wenige Fracht-Moleküle spezialisiert sind, wickeln diese in ihrem Inneren ein - und dort findet nicht jedes Molekül Platz", erklärt Thomas Güttler. Dagegen kann auf der Oberfläche von CRM1 Fracht nahezu beliebiger Größe und Form binden.

Das nächste Ziel der Wissenschaftler ist es nun, die Bindung weiterer Frachtmoleküle an CRM1 zu untersuchen. "CRM1 ist ein ganz entscheidender Spieler, wenn wir verstehen wollen, wie komplexe Zellen überhaupt funktionieren. Es ist nicht irgendein Transporter der Zelle, sondern das Arbeitstier des Kern-Exports schlechthin", so Dirk Görlich.
Originalveröffentlichung
Thomas Monecke, Thomas Güttler, Piotr Neumann, Achim Dickmanns, Dirk Görlich, Ralf Ficner. Crystal structure of the nuclear export receptor CRM1 in complex with Snurportin1 und RanGTP. Science Express, Online-Veröffentlichung, 23. April 2009 | DOI: 10.1126/science.1173388
Weitere Informationen
Die Abteilung Molekulare Strukturbiologie, Universität Göttingen
Die Abteilung Zelluläre Logistik, Max-Planck-Institut für biophysikalische Chemie
Kontakt
Prof. Dr. Ralf Ficner, Abteilung Molekulare Strukturbiologie
Georg-August-Universität Göttingen
Tel: +49 551 39 -14072
E-Mail: rficner@uni-goettingen.de
Prof. Dr. Dirk Görlich, Abteilung Zelluläre Logistik
Max-Planck-Institut für biophysikalische Chemie, Göttingen
Tel: +49 551 201 -1400
E-Mail: dgoerli@gwdg.de
Dr. Carmen Rotte, Presse- und Öffentlichkeitsarbeit
Max-Planck-Institut für biophysikalische Chemie, Göttingen
Tel: +49 551 201 -1304
E-Mail: crotte@gwdg.de

