Fehler am Anfang des Lebens
Forschungsbericht (importiert) 2021 - Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Neues Leben entsteht
Sobald eine Eizelle von einem Spermium befruchtet wird, werden die Gene des Vaters und der Mutter kombiniert. Spermium und Eizelle steuern jeweils eine Kopie der 23 Chromosomen bei, die die genetische Information (DNA) enthalten. Der Embryo erbt somit einen vollständigen Satz Chromosomen. Die Vorläuferzelle der Eizelle enthält noch zwei Kopien von jedem der 23 Chromosomen und muss daher vor der Befruchtung die Hälfte ihrer 46 Chromosomen eliminieren. Dies geschieht während eines speziellen Zellteilungsprozesses, der Meiose. Das Problem ist, dass dieser Prozess sehr fehleranfällig ist: Schon bei jungen Frauen tragen 10 bis 20 Prozent der Eizellen zu wenige oder zu viele Chromosomen. Bei Frauen über 40 Jahren sind es sogar mehr als 50 Prozent. Dies liegt daran, dass die unreifen Eizellen einer Frau bereits vor der Geburt produziert werden. Eine 40-jährige Frau hat also 40 Jahre alte Eizellen. Je älter die Frau und ihre Eizellen werden, desto wahrscheinlicher ist es, dass die reife Eizelle zu viele oder zu wenige Chromosomen hat. Dies ist eine der Hauptursachen für Fehlgeburten und Unfruchtbarkeit.
Instabilität von Chromosomen und Spindeln in Eizellen
Wir haben mehrere Faktoren aufgedeckt, die zu den hohen Fehlerquoten in Eizellen beitragen. Eine zelluläre Maschine, der Spindelapparat, sorgt dafür, dass eine reifende Eizelle die richtige Anzahl von Chromosomen enthält. Der Apparat besteht aus Spindelfasern, die während der Meiose an den Chromosomen ansetzen. Die Fasern ziehen eine Kopie jedes Chromosomenpaares zu einem der beiden gegenüberliegenden Pole. Danach teilt sich die Zelle zwischen diesen Polen. Wir fanden, dass der Spindelapparat in menschlichen Eizellen sehr instabil ist und sich oft falsch an die Chromosomen anlagert. Dies führt zu Fehlern bei der Chromosomentrennung.
Außerdem verändert sich die Architektur der Chromosomen, wenn Frauen älter werden. Sie fallen vorzeitig auseinander, noch bevor sie getrennt werden. Und auch spezielle Strukturen können auf den Chromosomen zerfallen und nicht mehr korrekt funktionieren, nämlich die sogenannten Kinetochore, an denen die Spindelfasern an den Chromosomen ansetzen.
Einblicke aus einem neuen Modellsystem
Interessanterweise passieren Chromosomentrennungsfehler nicht nur in der Eizelle, sondern auch im frühen Embryo von Säugetieren. Die Zeit unmittelbar nach der Vereinigung von Spermium und Eizelle, das sogenannte Zygotenstadium, scheint eine äußerst kritische Phase für die Entwicklung zu sein. Wir wollten herausfinden, warum dies der Fall ist. Für unsere Untersuchungen werteten wir Videos von menschlichen Zygoten aus, die Kolleginnen und Kollegen in der Bourn Hall Clinic in England aufgenommen hatten. Diese Klinik war die weltweit erste Klinik für In-vitro-Fertilisation (IVF). Dort werden im Rahmen der Kinderwunschbehandlung routinemäßig mikroskopische Videos von menschlichen Zygoten aufgenommen.
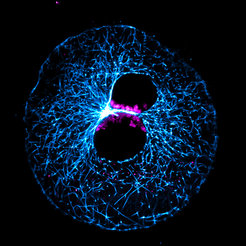
Molekulare Studien an menschlichen Zygoten sind vor allem aus ethischen Gründen begrenzt. Deshalb haben wir uns auf die Suche nach einem neuen Modellorganismus begeben, mit dem sich die frühe Embryonalentwicklung detailliert untersuchen lässt. Gemeinsam mit Forschenden am Institut für Nutztiergenetik des Friedrich-Loeffler-Instituts, Neustadt, haben wir Methoden entwickelt, um die ersten Teilungen einer Rinder-Zygote live zu beobachten. Zygoten von Rindern sind denen des Menschen sehr ähnlich, zum Beispiel, was die Anordnung der Chromosomen und die Organisation der Spindel betrifft. Auch die Häufigkeit von Fehlern bei der Chromosomentrennung während der ersten Zellteilungen ist in beiden Organismen ähnlich hoch. Ein weiterer Vorteil des Modellsystems Rind ist, dass wir die Eizellen für die Befruchtung aus Schlachthofabfällen gewinnen können. Es müssen also nicht Tiere geopfert werden.
Wir befruchteten die Rinder-Eizellen in vitro und verfolgten mithilfe hochauflösender Lebendzellmikroskopie, wie sich das elterliche Erbgut vereinigt. Nach der Befruchtung liegen die elterlichen Chromosomen zunächst in zwei getrennten Kernen vor, den Vorkernen (Abb. 1; [1]). Wir fanden, dass sich die elterlichen Chromosomen an der Grenzfläche der beiden Vorkerne ansammeln. Bei einigen Zygoten allerdings tanzten einzelne Chromosomen aus der Reihe. Infolgedessen gingen diese bei der Vereinigung des Erbguts verloren und die entstehenden Kerne besaßen zu wenige Chromosomen. Diese Zygoten wiesen, wie erwartet, bald Entwicklungsstörungen auf.
Das Zusammenlagern der Chromosomen an der Grenzfläche der beiden Vorkerne scheint also ein äußerst wichtiger Schritt zu sein. Gelingt die Ansammlung der Chromosomen nicht, passieren Fehler, die mit einer gesunden Embryonalentwicklung unvereinbar sind.
Abhängig von einem ineffizienten Prozess
Doch wie kommt es, dass sich die Chromosomen nicht korrekt versammeln? Unsere Ergebnisse zeigen, dass Komponenten des Zytoskeletts und der Kernhülle die Bewegung der Chromosomen innerhalb der Vorkerne steuern. Interessanterweise sind es dieselben Elemente, die auch dafür sorgen, dass sich die beiden Vorkerne aufeinander zubewegen. Die Vereinheitlichung des elterlichen Erbguts hängt also von zwei eng miteinander verknüpften Vorgängen ab, die lebenswichtig sind, aber oft schiefgehen. Ob sich ein Embryo gesund entwickelt oder nicht, hängt damit von einem bemerkenswert ineffizienten Prozess ab.
Unsere Erkenntnisse sind auch für die künstliche Befruchtung beim Menschen relevant. Hier diskutiert man schon länger, ob man die Ansammlung der sogenannten Kernkörperchen an der Vorkern-Grenzfläche als Indikator für die Chance auf eine erfolgreiche Befruchtung nutzen sollte. Zygoten, bei denen sich die Bestandteile der Vorkerne allesamt an der Grenzfläche sammeln, haben bessere Entwicklungschancen und könnten bevorzugt für eine Kinderwunschbehandlung verwendet werden. Unsere Beobachtung, dass sich auch die Chromosomen an der Grenzfläche sammeln müssen, um eine gesunde Entwicklung des Embryos zu garantieren, stützt dieses Auswahlkriterium.
