Wie Nervenzellen miteinander reden – molekulare Maschinen bei der Arbeit
How neurons talk to each other – molecular machines at work
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Unser Nervensystem besteht aus einer riesigen Zahl (etwa 100 Milliarden) von Nervenzellen oder Neuronen, die untereinander hochgradig vernetzt sind und dadurch zu komplexen Verrechnungen von Signalen in der Lage sind. Neurone enthalten eine Antennenregion, die durch den Zellkörper und durch als Dendriten bezeichnete Fortsätze gebildet wird und in der die Signale anderer Neurone empfangen werden. Die verrechneten Signale werden dann durch ein „Kabel“, das Axon, in Form von elektrischen Impulsen weitergeleitet. In der Senderregion verzweigt sich das Axon und bildet spezifische Kontaktstellen aus, die Synapsen, an denen die Signale auf andere Nervenzellen übertragen werden (Abb. 1). Hier werden die aus dem Axon eintreffenden elektrischen Impulse in chemische Signale umcodiert. Information fließt dabei nur in einer Richtung: Eine Zelle redet, die andere hört zu. Die Zahl der Synapsen, die eine einzelne Nervenzelle ausbilden kann, variiert sehr stark: Je nach Zelltyp kann sie zwischen genau einer und über 100.000 betragen, im Mittel sind es ungefähr 1.000 pro Neuron.
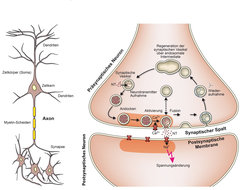
Synapsen – elementare Einheiten der neuronalen Informationsübertragung
Synapsen bestehen aus dem präsynaptischen Nervenende des Sender-Neurons, dem synaptischen Spalt, der die Sender- und Empfängerzelle trennt, und der postsynaptischen Membran des Empfänger-Neurons (Abb. 1). Die präsynaptischen Nervenenden enthalten die als Neurotransmitter bezeichneten Signalmokeküle, die in kleinen membranumschlossenen Kompartimenten, den synaptischen Vesikeln, gespeichert sind. Jedes Nervenende im zentralen Nervensystem enthält durchschnittlich mehrere hundert synaptische Vesikel. Allerdings ist die Variabilität sehr groß. So gibt es Spezialisten unter den Synapsen, die viele Hunderttausende von Vesikeln enthalten, darunter diejenigen Synapsen, die unsere Muskeln steuern. In der Synapse sind stets einige der Vesikel bereits in der Startposition direkt an der präsynaptischen Plasmamembran angedockt.
Wenn ein elektrisches Signal im Nervenende eintrifft, werden Calcium-Kanäle in der Plasmamembran aktiviert, durch die Calcium-Ionen vom Außenraum in das Innere der Synapse strömen. Sie treffen auf eine molekulare Maschine, die sich zwischen der Membran der Vesikel und der Plasmamembran befindet und die durch die hereinströmenden Calcium-Ionen eingeschaltet wird. Diese Maschine bewirkt, dass die Membran der synaptischen Vesikel mit der Plasmamembran verschmilzt (Fusion), wodurch die in den Vesikeln gespeicherten Neurotransmitter-Moleküle in den synaptischen Spalt ausgeschüttet werden. Auf der anderen Seite des synaptischen Spaltes treffen die Transmittermoleküle auf Rezeptoren in der postsynaptischen Membran, die die elektrischen Eigenschaften der postsynaptischen Membran regulieren. Dadurch ändert sich der Membranwiderstand und es erfolgt zumeist eine Spannungsänderung, die nun vom Empfängerneuron verarbeitet werden kann. Zwischen dem Eintreffen des Impulses in der Präsynapse bis zur Spannungsänderung auf der postsynaptischen Seite vergeht nur etwa 1/1000 Sekunde. Damit stellt die synaptische Übertragung einen der schnellsten biologischen Vorgänge dar, wenngleich geradezu noch schneckenartig langsam im Vergleich mit einem Transistor.
Synaptische Vesikel – Speicherorganellen für die Neurotransmitter
Synaptische Vesikel sind keineswegs nur eine Art membranumhüllte „Konservendose“ zur Speicherung der Neurotransmitter. In ihrer Membran befinden sich eine ganze Reihe von Proteinen, die sich seit Millionen von Jahren durch die Evolution kaum verändert haben. Eine Gruppe dieser Proteine ist dafür verantwortlich, Neurotransmitter-Moleküle aus dem Cytoplasma in die Vesikel hineinzutransportieren und dabei hoch anzureichern. Die dafür erforderliche Energie wird von einem weiteren Proteinmolekül zu Verfügung gestellt: einer Protonen-ATPase, die unter Verbrauch von ATP Protonen in die Vesikel hineinpumpt. Dadurch entsteht ein Konzentrationsgefälle, welches die Transmitterpumpen ihrerseits für die Aufnahme von Neurotransmittern ausnutzen.
Neben diesen für das „Auftanken“ erforderlichen Proteinen enthalten die Membranen synaptischer Vesikel weitere Komponenten, die dafür sorgen, dass die Vesikel mit der Plasmamembran verschmelzen können und nach der Membranfusion wieder in das Nervenende zurücktransportiert werden. Synaptische Vesikel werden anschließend im Nervenende über einige Zwischenschritte wieder regeneriert und neu mit Neurotransmitter befüllt, und das viele tausend Male im Lebenszyklus eines synaptischen Vesikels (Abb. 1).
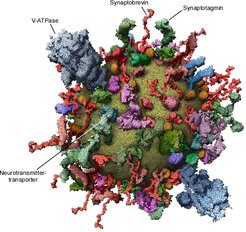
Ein wesentliches Ziel der Forscher um Reinhard Jahn besteht darin, die Funktionsweise von synaptischen Vesikeln auf molekularer Ebene zu verstehen. Hierzu ist vor einigen Jahren ein umfassendes Inventar aller Vesikelbestandteile erstellt worden. Wegen der Kleinheit der Vesikel und der Komplexität ihrer Zusammensetzung war dieses Unterfangen keineswegs einfach: Mehrere Teams aus Deutschland, Japan, der Schweiz und den USA mussten jahrelang zusammenarbeiten, um die Protein- und Lipidkomponenten der Vesikel zu identifizieren und ein quantitatives molekulares Modell eines Standardvesikels zu erstellen (Abb. 2, [1]). Dabei mussten Probleme gelöst werden, die keineswegs so einfach waren, wie man annehmen möchte, z. B. das Auszählen der Vesikel in einer Lösung oder die quantitative Bestimmung des Gehaltes von Proteinen und Membranlipiden. Die Ergebnisse waren auch für Experten überraschend. So stellte sich heraus, dass ein biologisches Transportvesikel in seiner Struktur viel stärker durch Proteine bestimmt wird als zuvor angenommen: Wenn man von außen auf das Vesikelmodell schaut, kann man die Lipidmembran (gelb) vor Proteinen kaum erkennen, und dabei sind im Modell nur ca. 70 Prozent der Gesamtmenge an Protein enthalten. Diese Arbeiten bilden die Grundlage zu weiterführenden Untersuchungen. So ist es gelungen, Vesikel, die unterschiedliche Neurotransmitter transportieren, voneinander zu trennen und miteinander zu vergleichen. Anders als vorher vermutet, unterscheiden sie sich nur geringfügig in ihrer Proteinzusammensetzung. Außerdem konnten Vesikelpopulationen isoliert werden, die bereits an der Plasmamembran angedockt sind, was eine Analyse ihrer Proteinzusammensetzung erlaubte.
Molekulare Grundlagen der exocytotischen Membranfusion
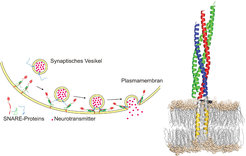
Ein zweiter Schwerpunkt besteht darin, die für die Membranfusion verantwortliche Proteinmaschine in ihren funktionellen Details zu verstehen. Die dafür verantwortlichen Proteine sind bereits seit über zehn Jahren bekannt, doch ist immer noch nicht klar, wie sie es schaffen, innerhalb von weniger als einer Millisekunde nach Einstrom der Calcium-Ionen die Membranen zu verschmelzen. Für die Fusion selber sind sogenannte SNARE-Proteine verantwortlich – kleine Proteinmoleküle, die in der Plasmamembran wie in der Vesikelmembran sitzen. Kommen die Membranen nahe aneinander, lagern sich die SNARE-Proteine aneinander, wobei sie sich in Richtung der Membran wie Taue miteinander verdrillen – wissenschaftlich ausgedrückt: sie bilden ein Bündel von α-Helices in Form eines coiled-coils (Abb. 3). Bei dieser Zusammenlagerung wird Energie freigesetzt, die für das Verschmelzen der Membranen benutzt wird. Neuere Untersuchungen haben ergeben, dass das verdrillte Bündel bis in die Membran hineinreicht [2]. Um zu verstehen, wie diese Zusammenlagerung die Verschmelzung der Membranen bewirkt, wurden die SNARE-Proteine in künstliche Membranen eingebaut, an denen man die Fusion mit hochauflösenden Methoden, darunter der Kryo-Elektronenmikroskopie, untersuchen kann. Dabei wurden erstmalig Zwischenstufen der Fusionsreaktion identifiziert und es konnte ein Modell der einzelnen Schritte auf molekularer Ebene erstellt werden [3]. Fortschritte sind ebenfalls bei der Frage erzielt worden, wie die einströmenden Calcium-Ionen die Fusionsmaschine aktivieren. Dies wird durch ein weiteres Protein in der Membran synaptischer Vesikel vermittelt, das Synaptotagmin, welches die Calcium-Ionen bindet und dann die Membranen etwas näher aneinander bringt, wodurch die Zusammenlagerung der SNARE-Proteine ausgelöst wird [4, 5].


![Abb. 3: Links: Modell der SNARE-vermittelten Membranfusion. Rechts: Strukturmodell des zusammengelagerten SNARE-Komplexes (aus [2]) Abb. 3: Links: Modell der SNARE-vermittelten Membranfusion. Rechts: Strukturmodell des zusammengelagerten SNARE-Komplexes (aus [2])](https://www.mpg.de/11592384/original-1508156605.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE1OTIzODR9--b083c8cd03bcf601acb4c429fefe8211da59388a)