Nanopartikel auf der Waage
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Nanopartikel sind heute wichtige Bestandteile alltäglicher Produkte, darunter Medikamente, Kosmetikartikel und Oberflächenvergütungen. Der Begriff „Nano“ ist meist sehr weit gefasst und bezieht sich auf all jene Objekte, deren Größe die einzelner Moleküle übersteigt, aber noch unterhalb von einhundert Nanometern liegt. Auch elementare Bestandteile biologischer Systeme, wie große Biomolekülkomplexe, Viren, und kleine Zellorganellen sind Nanopartikel, deren Eigenschaften und Verteilung sich entscheidend auf die Funktion eines größeren Organismus auswirken können. Zum Beispiel besteht eine enge Verbindung zwischen dem Auftreten bestimmter neurodegenerativer Erkrankungen und der Bildung nanoskopischer Proteinaggregate in einem bestimmten Größenbereich. Derartige Korrelationen zwischen der Funktion und der Größe, Masse, oder Konzentration nanoskopischer Objekte sind nicht nur in der Grundlagenforschung, sondern auch für Fortschritte in der medizinischen Diagnostik und Therapeutik von großem Interesse. Dennoch gibt es heute nur wenige experimentelle Methoden, welche einen Zugang zu dem Größenbereich zwischen zehn und hundert Nanometern bieten.
Mit einer Stimmgabel wiegen
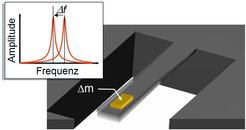
Nanomechanische Proben ermöglichen seit einigen Jahren hochpräzise physikalische Messungen in diesem Größenbereich zwischen einzelnen Molekülen und der Auflösungsgrenze konventioneller optischer Mikroskope. Die Messung kleinster Massen hat dabei einen besonderen Stellenwert, da die Masse eine grundlegende Eigenschaft aller Materie ist, welche unabhängig von der chemischen oder biologischen Beschaffenheit eines Objekts gemessen werden kann. Das Prinzip nanomechanischer Massesensoren besteht darin, einen Biegebalken (engl. Cantilever), dessen Dicke nur etwa einem Hundertstel eines menschlichen Haars entspricht, in Schwingungen zu versetzen und dessen charakteristische Frequenz zu bestimmen (Abb. 1). Kleine Masseänderungen führen ähnlich wie bei einer Stimmgabel zu einer Verschiebung der Resonanzfrequenz. Die Verschiebung fällt umso größer aus, je geringer die Masse des Resonators selbst ist, weshalb die Empfindlichkeit der Methode rasch steigt, wenn der Resonator verkleinert wird. Die genauesten Messungen, welche bis heute mit diesem Prinzip demonstriert werden konnten, erreichten eine Empfindlichkeit von unter 10-21 Gramm – ungefähr die Masse eines einzelnen Goldatoms [1]. Diese hohe Präzision kann jedoch nur unter hochreinen Vakuumbedingungen erreicht werden.
Eine zentrale Hürde für die Anwendung nanomechanischer Resonatoren auf biologische Fragestellungen war es lange Zeit, die Erfordernisse präziser Resonanzfrequenzmessungen mit der Notwendigkeit eines flüssigen Mediums in Einklang zu bringen. Im Gegensatz zu Messungen in Luft oder Vakuum hat die hohe Viskosität von Flüssigkeiten eine starke Dämpfung der Schwingung zur Folge. Außerdem verringert die mitbewegte Masse die Sensitivität. Aufgrund dieser Probleme bedarf es eines Tricks, der die genaue nanomechanische Messung von Masse in Flüssigkeiten überhaupt möglich macht. Anstatt den Biegebalken in der flüssigen Probe in Schwingungen zu versetzen, wird die Probe durch einen nanofluidischen Kanal im Inneren des Biegebalkens geleitet. Die Schwingfrequenz gibt nun Auskunft über die Gesamtmasse, welche sich aus dem Resonator selbst, der Flüssigkeit, und allen darin gelösten Stoffen zusammensetzt. Da der Resonator bei dieser Methode von einem Vakuum umgeben ist, wird die Schwingung nahezu nicht gedämpft und die Frequenz kann mit sehr hoher Genauigkeit gemessen werden.
Ein Maß für die Dämpfung der Vibration ist der Gütefaktor, welcher die Schärfe der Resonanz, oder, in Analogie zur Musik, die Reinheit eines Tons beschreibt. Während konventionelle Cantilever-Resonatoren in Flüssigkeit einen Gütefaktor von <1 aufweisen und die besten, für Anwendungen in Lösung optimierten Strukturen kaum einen Wert von 100 erreichen, besitzen nanofluidische Resonatoren in Vakuum eine Güte von zehn- bis zwanzigtausend. Dadurch wird es möglich, die Resonanzfrequenz mit einer Genauigkeit besser als 1:108 zu bestimmen.
Bei genauerer Untersuchung der verbleibenden, extrem niedrigen Dämpfung stößt man auf ein interessantes und komplexes Zusammenspiel hydrodynamischer Effekte [2]. Diese haben eine nicht-monotone Beziehung zwischen der Strukturgröße und dem Gütefaktor zur Folge, was im Bereich der Nanomechanik höchst ungewöhnlich ist. Maßgeblich für die Größe der Reibungsverluste ist das Verhältnis zwischen der Kanalhöhe und der sogenannten Stokes-Länge, welche die Distanz angibt, über welche die Vibration der Kanalwand in die Flüssigkeit eindringt. Je nach Frequenz und Viskosität liegt diese Länge im Bereich von einigen hundert Nanometern. Verringert man die Kanalhöhe unter diesen Wert, gleicht die Bewegung der Flüssigkeit einem Festkörper und Reibungsverluste verschwinden zumindest in der Theorie nahezu vollständig. In der Realität gibt es viele von der Theorie noch nicht erfasste Effekte, welche zusätzliche Verluste bewirken können und daher für das Erreichen der fundamentalen Grenzen besser verstanden werden müssen.
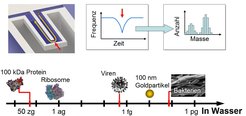
Obwohl die genauesten nanomechanischen Waagen in Flüssigkeit noch weit von der Empfindlichkeit entfernt sind, welche im Hochvakuum erreicht werden, gab es seit der ersten Demonstration des Prinzips im Jahr 2003 große Fortschritte [3]. Durch die Entwicklung neuer Herstellungsverfahren steigerte sich die Empfindlichkeit bis 2007 von ca. 1 Pikogramm (etwa die Masse eines einzelnen Bakteriums) um das 103-fache auf unter 1 Femtogramm [4]. Damit war es zum ersten Mal möglich, die Masseverteilung einzelner Bakterien und Nanopartikel in Lösung direkt zu messen. Da die Partikel bei der Messung nicht direkt mit dem Schwingkörper interagieren, können große Mengen einzelner Partikel sequenziell charakterisiert werden. Das Einzigartige daran ist, dass so die vollständige statistische Größenverteilung heterogener Proben mit großer Genauigkeit in einem Schritt ermittelt werden kann (Abb. 2).
Auf dem Weg zu einzelnen Molekülen
Weitere Verbesserungen der Sensitivität in den Bereich unterhalb eines Attogramms, also eines milliardstel eines milliardstel Gramms, sind für zahlreiche Anwendungen wichtig. Insbesondere Fragestellungen zum besseren Verständnis von Aggregationsprozessen in Biotechnologie, Medizin, Biophysik und Zellbiologie erfordern genauere Methoden zur Charakterisierung solcher Prozesse unter verschiedenen Bedingungen. Durch fortschreitende Miniaturisierung gelang es den Forschern des Max-Planck-Instituts für biophysikalische Chemie und des Massachusetts Institute of Technology kürzlich, eine Empfindlichkeit von unter 100 ag zu erreichen [5]. Jedoch ist eine weitere Reduktion der Abmessungen mit optischer Lithographie höchstens noch geringfügig möglich.

Um diese Einschränkungen zu überwinden, wurde in einer Zusammenarbeit des MPI für biophysikalische Chemie mit dem Forschungszentrum caesar ein neues Verfahren entwickelt, welches es erlaubt, die Kanalwandstärke und den Kanalquerschnitt gegenüber den bisher empfindlichsten Strukturen um den Faktor 10 bis 20 zu reduzieren. Zusätzlich wird durch die Verwendung von Siliziumoxid anstelle von einkristallinem Silizium als Wandmaterial eine gleichzeitige Messung von Masse und Fluoreszenz möglich (Abb. 3).
Langfristig verspricht die Entwicklung einer neuen Generation nanofluidischer Massesensoren ein flüssigkeitsbasiertes Analog zur Massenspektrometrie für die Untersuchung kleinster Partikel und Molekülkomplexe mit einer Größe von unter hundert Nanometern zu schaffen. Fortschritte in diesem Gebiet helfen dabei, unser Verständnis der Funktionen und Eigenschaften komplexer Strukturen im Nanometerbereich zu erweitern, und sind damit für industrielle und medizinische Anwendungen ebenso von Bedeutung wie für Fortschritte in der Grundlagenforschung.


