Magnetresonanz-Tomografie in der Neurobiologie – von Maus bis Mensch
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Fortschritte in der Biologie auf genetischer, molekularer und zellulärer Ebene werden zunehmend von neuartigen bildgebenden Verfahren begleitet. Dies gilt sowohl für optische Methoden, etwa im Bereich der Fluoreszenz-Mikroskopie, als auch für die nichtinvasiven Verfahren der Magnetresonanz-Tomografie (MRT), die eine Untersuchung lebender Systeme und intakter Organismen eröffnen. Ein besonders fruchtbares Anwendungsfeld stellen die Neurowissenschaften dar, wo moderne MRT-Techniken einzigartige Einblicke in die Struktur, den Stoffwechsel und die Funktion des zentralen Nervensystems bieten. Die MRT-Ansätze verbinden dabei einerseits In-vitro-Untersuchungen an Zellen und Geweben mit der In-vivo-Bildgebung anästhesierter Versuchstiere und schlagen andererseits eine Brücke von tierexperimentellen Studien zu Untersuchungen des menschlichen Gehirns. Auf diese Weise wird es erstmalig möglich, neurogenetische und molekularbiologische Erkenntnisse direkt an die bildgebende medizinische Diagnostik und Therapiekontrolle am Patienten heranzuführen.
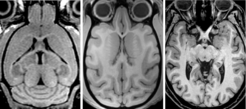
Die Biomedizinische NMR (Nuklearmagnetische Resonanz) verknüpft die methodische Weiterentwicklung der Magnetresonanz-Tomografie mit neurobiologischen Fragestellungen, die im Tiermodell oder auch direkt am Menschen bearbeitet werden. Aktuelle methodische Schwerpunkte beziehen sich vor allem auf eine verbesserte Bildgebung mit Hochgeschwindigkeits-Messtechniken, den Einsatz von Mehrfachspulen zur parallelen Datenaufnahme, die Erprobung neuartiger (nicht-kartesischer) Ortskodierungen für die Datenaufnahme sowie die Nutzung komplexer Verfahren der numerischen Mathematik zur Bildrekonstruktion, die die bisher verwendete einfache Fourier-Transformation ablösen. Das Spektrum der MRT-Anwendungen in der Neurobiologie reicht von Insekten über Nager und nicht-menschliche Primaten bis zum Menschen. Die Abbildung 1 zeigt Schnittbilder aus dreidimensionalen MRT-Aufnahmen des Gehirns von Maus, Rhesusaffe und Mensch. Die folgenden Abschnitte stellen ausgewählte Forschungsvorhaben dar.
Mausmodelle neuroaxonaler Veränderungen
Zentrale Tiermodelle menschlicher Hirnerkrankungen sind heute genetisch modifizierte Mäuse. Im direkten Vergleich mit histologischen Befunden bieten tierexperimentelle MRT-Untersuchungen des lebenden Gehirns die Chance, den Signalveränderungen in der MRT eine pathophysiologische Bedeutung zuzuordnen und ein grundlegenderes Verständnis für die Diagnostik am Menschen zu gewinnen. Zugleich lassen sich In-vivo-Marker und Kriterien für eine frühe Kontrolle der Wirksamkeit neuer therapeutischer Ansätze, etwa im Bereich der Neuroprotektion oder Remyelinisierung, ableiten. Diese Ziele werden auf vielversprechende Weise durch funktionelle MRT-Verfahren (siehe nachstehende Abschnitte) und den Einsatz neuartiger Kontrastmittel erweitert, die mittels paramagnetischer Nanopartikel Biomoleküle oder Zellen markieren und eine Brücke zur Fluoreszenz-Mikroskopie schlagen.
Ein aktueller Schwerpunkt sind neuroaxonale Schädigungen des zentralen Nervensystems. In Zusammenarbeit mit Abteilungen des MPI für experimentelle Medizin (Nils Brose, Hannelore Ehrenreich, Klaus-Armin Nave) wird das gesamte Spektrum moderner MRT-Verfahren für eine In-vivo-Charakterisierung von Mausmodellen genutzt, die sich in der Regel durch selektive Veränderungen der axonalen Integrität und/oder der die Nervenfortsätze (Axone) ummantelnden Myelinschicht auszeichnen. Derartige Schädigungen stellen Kernelemente menschlicher Hirnerkrankungen dar – beispielsweise der Multiplen Sklerose, aber auch von Schizophrenie und Autismus.
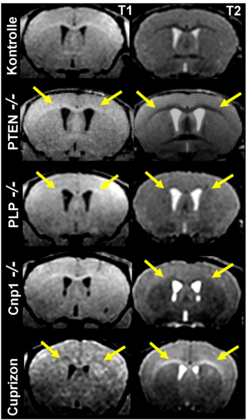
Die Abbildung 2 zeigt MRT-Aufnahmen von Mausmodellen, die sich im Vergleich zu Kontrolltieren durch eine markante Hypermyelinisierung (PTEN -/-), eine dominante axonale Schädigung mit milder (PLP -/-) bzw. keiner Strukturveränderung des Myelins (Cnp1 -/-) sowie durch eine reversible Demyelinisierung ohne offensichtliche axonale Schädigung (pharmakologisches Modell) auszeichnen. Die Aufnahmen illustrieren auf exemplarische Weise komplementäre Veränderungen der MRT-Kontraste in der weißen Hirnsubstanz, die sich besonders gut im weißen Balken (Corpus Callosum) erkennen lassen.
Axonale Konnektivität – der weiße Balken
Die weiße Hirnsubstanz wird aus den mit Myelinscheiden ummantelten Fortsätzen der Nervenzellen gebildet. Diese Axone gestatten die Übertragung von Informationen über größere Entfernungen – zwischen den einzelnen Funktionseinheiten in der Großhirnrinde, zu tiefer liegenden Zentren im Mittelhirn und Kleinhirn oder durch das Rückenmark bis zu den peripheren Nerven, die die Muskeln innervieren. In der Regel werden die Nervenfortsätze einer Region als Faserbahn in einem Strang gebündelt. Derartige Strukturen können mit dynamischen MRT-Messungen der richtungsabhängigen Beweglichkeit der Wassermoleküle im Gewebe bildlich dargestellt werden. Dazu wird die in jedem Bildpunkt vorliegende Vorzugsrichtung der Bewegung bestimmt und der strukturellen Ausrichtung des zugrunde liegenden Bündels aus Nervenfasern zugeordnet. Anschließend lässt sich die Information nutzen, um von Bildpunkt zu Bildpunkt mithilfe einfacher Algorithmen eine Nervenfaserbahn dreidimensional zu verfolgen.
Mit einem neu entwickelten MRT-Verfahren, das bisherige messtechnisch bedingte Bildfehler vollständig vermeidet, wurde erstmalig eine umfassende Charakterisierung des weißen Balkens im intakten menschlichen Gehirn erzielt. Diese größte Struktur der weißen Hirnsubstanz gewährleistet in zentraler Lage den Informationsaustausch zwischen den beiden Hirnhälften, wobei die Faserbahnen hauptsächlich gleichartige Funktionszentren in der jeweils gegenüberliegenden Großhirnrinde miteinander verknüpfen. Die Abbildung 3 zeigt eine vollständige Identifizierung und Zuordnung dieser Faserbahnen im Gehirn einer gesunden Versuchsperson. Die Ergebnisse zeigen ein neues Bild von der geordneten Reihung (Topographie) der Kreuzungsgebiete gleichartiger Faserbahnen. Insbesondere die Bahnen aus den primären motorischen und sensorischen Hirnrinden verlaufen eindeutig weiter hinten als bisher angenommen. Frontale Areale des Gehirns werden im vorderen Bereich des weißen Balkens verbunden, während Bahnen der visuellen Funktionsgebiete im okzipitalen Kortex den hintersten Abschnitt des Balkens kreuzen.

Kognitive Informationsverarbeitung – ein Beispiel
Auch die graue Hirnsubstanz ist einer funktionellen Kartierung durch geeignete MRT-Verfahren zugängig. Sie nutzen die fokale Änderung der Sauerstoffsättigung des Blutes bei neuronaler Aktivierung, um die funktionelle Anatomie des individuellen menschlichen Gehirns mit bisher unerreichter räumlicher Auflösung zu bestimmen. Die Methode basiert auf den Kontrasteigenschaften des paramagnetischen Desoxyhämoglobins in den Blutgefäßen.
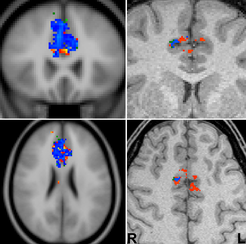
Neben methodischen Arbeiten zu den physiologischen Grundlagen sowie zu besonders hochauflösenden Messverfahren, die bis zu einer Darstellung kolumnarer und laminarer Strukturen der Großhirnrinde reichen, befassen sich aktuelle Untersuchungen mit der Modulation primärer sensorischer Systeme durch Aufmerksamkeitsprozesse sowie der Umsetzung bzw. Überprüfung etablierter neuropsychologischer Testparadigmen zur Charakterisierung höherer kognitiver Leistungen. Ein besonderes Beispiel stellen die Mechanismen von Konfliktbewältigung und Fehlerverarbeitung im menschlichen Gehirn dar, die mit einer so genannten Go-Nogo-Aufgabe getestet wurden. Die Aufgabenstellung verlangt es, einen durch eine Reihe schneller Entscheidungen erzeugten, vorherrschenden Motorimpuls (Go = Tastendruck mit einem Finger) bei selten auftretenden Alternativ-Ereignissen zu unterdrücken (Nogo). Da die Schwierigkeit der Aufgabe durch die Kürze der zur Entscheidung eingeräumten Zeit gesteuert werden kann, machen die Probanden zahlreiche Fehler. Die in Abbildung 4 zusammengefassten Aktivierungskarten funktioneller MRT-Messungen belegen eine Aufteilung der beteiligten Verarbeitungsschritte auf die Anteile des hierfür „zuständigen“ anterioren zingulären Kortex (ACC) in der rechten und linken Hirnhälfte. Während der linke ACC selektiv auf Fehler reagiert (rote Aktivierungen), ist der rechte ACC sowohl bei erfolgreicher (grün) als auch fehlgeschlagener (rot) Unterdrückung der Fingerbewegung beteiligt (blaue Überlappung) und zeigt damit eine eher allgemeine Funktion in der Konfliktverarbeitung. Aus methodischer Sicht ist festzustellen, dass diese Ergebnisse nicht mit den üblichen funktionellen MRT-Verfahren, sondern nur bei deutlich erhöhter räumlicher Auflösung sichtbar werden.