Prägung der Zellidentität in der Bauchspeicheldrüse
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Einleitung
Die verschiedenen Organe in unserem Körper sind mit Fabriken zu vergleichen, die sich auf bestimmte Aufgaben spezialisiert haben. Die Entwicklung (Reifung) eines funktionsfähigen Organs (Organogenese) läuft nach einem vorgegebenen und komplizierten genetischen Programm ab. Die Aufschlüsselung der molekularen Mechanismen, die die Reifung eines Organs kontrollieren, ist für die biomedizinische Forschung von grundlegender Bedeutung.
So ist zum Beispiel bei Diabetes Typ I die Funktion bestimmter Zellen in der Bauchspeicheldrüse beeinträchtigt. Das Pankreas besteht hauptsächlich aus zwei Zelltypen: Den überwiegenden Teil dieser Drüse machen die Azinus-Zellen aus, die Verdauungssäfte produzieren, die anschließend in den Zwölffingerdarm abgegeben werden. Dagegen beträgt der endokrine Teil der Drüse etwa zwei Prozent der Zellmasse und ist in kleinen Verbänden organisiert, die als Langerhans´sche Inseln bezeichnet werden. Diese Zellinseln sind im exokrinen Gewebe verteilt und stellen die Synthese-Orte der Hormone dar, die in das Blut abgegeben werden, um den Zuckerspiegel zu regulieren. Ein Ausfall dieser Funktion resultiert in bestimmten Formen von Diabetes.
Die Inselzellen: Funktionseinheiten des endokrinen Pankreas
Im endokrinen Pankreas unterscheidet man vier verschiedene Hormon-produzierende Zelltypen, von denen β-Zellen Insulin, α-Zellen Glukagon, δ-Zellen Somatostatin und die γ-Zellen das pankreatische Polypeptid (PP) produzieren. Die Insulin-produzierenden beta-Zellen stellen die Mehrzahl der endokrinen Zellen dar und bilden den Kern der Langerhans´schen Inseln (Abb. 1). An der Peripherie sind die restlichen α-, δ- und γ-Zellen lokalisiert.

In der Abteilung Molekulare Zellbiologie beschäftigt sich eine Arbeitsgruppe mit den molekularen Mechanismen, die die Reifung der einzelnen endokrinen Zelltypen im Pankreas steuern. Dabei geht es um die Identifizierung von Faktoren, die für die Prägung der β-, α-, δ- und γ-Zellen notwendig sind. Es stellt sich hier die Frage, wie sich aus so genannten Vorläuferzellen des Pankreas verschiedene funktionsfähige endokrine Zellen ausbilden und zu Langerhans´schen Inseln organisieren. Für diese Untersuchungen ist die Maus ein geeignetes Tiermodell. Molekulare und embryologische Techniken erlauben es, die Aktivität solcher Faktoren im Laufe der Reifung von endokrinen Zellen im Pankreas zu lokalisieren und deren Funktion mit Hilfe von so genannten Knockout-Mäusen herauszufinden. Bei diesen Mäusen wird die Aktivität eines bestimmten Gens gezielt ausgeschaltet, um aus den Folgen, häufig einem Funktionsverlust, Rückschlüsse auf die Rolle dieses Gens zu ziehen.
Zwei Kontrollgene steuern die Bildung der Vorläuferzellen im endokrinen Pankreas
Die Vorläuferzellen des endokrinen Pankreas werden bereits in den frühen Stadien der Embryonalentwicklung gebildet. Sie müssen bis zur Reifung verschiedene Stadien durchlaufen. Zuerst handelt es sich um primitive Zellen, aus denen sowohl endokrine als auch exokrine Zellen hervorgehen können. Die Aktivität oder Expression eines bestimmten Faktors, Pdx1, bestimmt, welche Zellen sich zu Pankreas entwickeln sollen. Fehlt einem Embryo ein funktionsfähiges Pdx1-Gen, so wird die Bauchspeicheldrüse nicht mehr gebildet. Pdx1 gehört einer Familie von Transkriptionsfaktoren an. Transkriptionsfaktoren sind Kontrollgene, die in der Lage sind, spezifische Sequenzen auf der DNA zu erkennen und dabei andere Gene ein- oder auszuschalten. Man kann sich vorstellen, dass durch die selektive Expression verschiedener Kontrollgene die Variabilität der Zellen und somit ihre Identität geprägt werden kann.
In der Tat führt die Expression eines weiteren Transkriptionsfaktors, Ngn3, dazu, dass nur ein Teil der Pdx1-positiven Zellen einen endokrinen Lebensweg einschlagen. Die übrigen Ngn3-negativen Zellen werden die exokrine Komponente der Bauchspeicheldrüse bilden. So genannte Ngn3-Knockout-Mäuse, die keine Ngn3-Aktivität mehr aufweisen, zeigen ein Pankreas, das ausschließlich aus dem exokrinen Anteil besteht. Sind die Vorläuferzellen der Bauchspeicheldrüse durch die Expression von Ngn3 für die Entwicklung zu einem endokrinen Anteil bestimmt, so ist es noch unklar, wie daraus funktionsfähige Hormon-produzierende Zellen hervorgebracht werden.
Pax4 und Arx: Zwei Faktoren prägen die Identität der endokrinen Zellen
Einen ersten Hinweis brachte den Göttinger Wissenschaftlern die Identifizierung des Pax4-Gens. Dieser Transkriptionsfaktor ist in β-Zellen und deren Vorläufern aufzufinden. Der Verlust der Aktivität dieses Paired-box-Gens hatte zur Folge, dass Knockout-Mäuse nach der Geburt verstarben, obwohl morphologisch normale Inselzellen gebildet wurden. Eine eingehende Analyse der Bauchspeicheldrüse zeigte, dass in diesen Mäusen die Langerhans´schen Inselzellen weder β- noch δ-Zellen enthalten. Interessanterweise besteht der Kern dieser Inselzellen ausschließlich aus Glukagon-produzierenden α-Zellen. Damit scheint das Pax4-Gen die Prägung der β- und δ-Zellen zu steuern [1]. Mansouri und sein Team gehen davon aus, dass es dabei die Vorläuferzellen daran hindert, eine α-Zellidentität anzunehmen.
Nach diesen Ergebnissen hätte eine endokrine Vorläuferzelle im Laufe der Reifung die Wahl zwischen zwei Wegen. Trifft sie auf Pax4-Aktivität, so ensteht eine Zelle, aus der sowohl Insulin- als auch Somatostatin-produzierende Nachkommen hervorgehen. Ohne Pax4 wird der Signalweg einer α-Zelle bevorzugt. Es bleibt dennoch spannend zu erfahren, wie aus der Pax4-positiven Zellpopulation die β- oder δ-Zellen hervorgehen und somit differenzieren. Eine Teillösung des Problems ergab die Identifizierung eines neuen Kontrollgens der Homeobox-Genfamilie, Arx, das auch in den endokrinen Vorläuferzellen vorkommt. Patrick Collombat fand im Rahmen seiner Promotionsarbeit heraus, dass der Verlust der Arx-Genaktivität bei Mäusen die Eliminierung aller Glukagon-produzierenden Zellen zur Folge hat (Abb. 2).
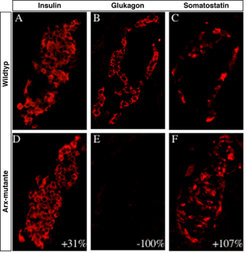
Überraschend war die dabei auftretende erhöhte Anzahl von Insulin- und Somatostatin-exprimierenden Zellen. Das Fehlen der Arx-Genaktivität scheint im endokrinen Pankreas den entgegengesetzten Defekt hervorzurufen, der bei Pax4-Knockout-Mäusen beobachtet worden ist [2]. Im Pankreas von Pax4-defizienten Mäusen findet eine Änderung der endokrinen Zellzusammensetzung statt, wobei die Insulin-produzierenden Zellen eine α-Zellidentität annehmen und keine δ-Zellen mehr zu beobachten sind. Die aus den einzelnen Verlustmutanten von Pax4 und Arx beschriebenen Veränderungen der Zellpopulationen im endokrinen Pankreas legten nahe, dass bei der Differenzierung der einzelnen endokrinen Zelltypen eine molekulare Interaktion zwischen Arx und Pax4 notwendig ist. Dieser Verdacht bestätigte sich, als die Analyse der Pax4-Knockout-Mäuse eine Erhöhung der Arx-Genaktivität (Transkription) in den endokrinen Zellen zeigte. Umgekehrt unterliegt das Pax4-Gen in Arx-Knockout-Mäusen einer erhöhten Expression in den endokrinen Zellen.
Reifung der endokrinen Zellen im Konzert der Gene
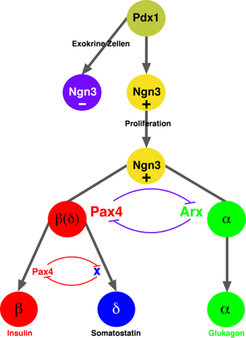
Auf molekularer Ebene konnten die Forscher den Beweis erbringen, dass Arx und Pax4 eine direkte Interaktion eingehen, wodurch eine antagonistische Wechselwirkung zustande kommt. Das Pax4-Protein ist in der Lage, an spezifische DNA-Sequenzen des Arx-Gens zu binden und eine Hemmung der Genaktivität zu erreichen. Durch den gleichen Mechanismus unterbindet das Arx-Protein die Pax4-Genaktivität in endokrinen Zellen. Dieser Mechanismus ermöglicht es, wie schematisch in Abbildung 3 dargestellt, dass aus den endokrinen Vorläuferzellen des Pankreas funktionell verschiedene Zelltypen generiert werden können.
Eine endokrine Vorläuferzelle wird aus dem Pool des sich entwickelnden Pankreasgewebes durch die Expression des Ngn3-Gens identifiziert. Nach einer Expansionsphase (Proliferation) werden diese naiven Zellen einer differenziellen Ausreifung unterzogen, wodurch verschiedene Zelltypen des endokrinen Pankreas hervorgebracht werden. Bei diesem Prozess spielen Pax4 und Arx eine entscheidende Rolle. In solchen Zellen, wo das Pax4-Gen aktiv ist, wird die Arx-Expression herunterreguliert und es entstehen vorwiegend endokrine Zellen mit dem Potenzial, in Insulin- und Somatostatin-produzierende Zellen zu differenzieren. Überwiegt jedoch die Expression von Arx, so werden α-Zellen dort gebildet, wo gleichzeitig eine Inaktivierung des Pax4-Gens erfolgt. Da in den Vorläuferzellen des endokrinen Pankreas die Expression von Arx und Pax4 nachgewiesen werden konnte, wird davon ausgegangen, dass sie in einer nicht aktiven Form vorliegen müssen. Die Aktivierung von Pax4 und/ oder Arx löst die Differenzierung der Vorläuferzellen aus. Daher wird ein noch nicht identifizierter Faktor postuliert, der im endokrinen Pankreas eine solche Funktion aufweist. Eine der künftigen Aufgaben ist daher die Identifizierung dieses Faktors. Weiterhin bleibt nach wie vor die Frage ungeklärt, wie aus Pax4-positiven Zellen sowohl Insulin- als auch Somatostatin-Zellen gebildet werden.
Eine weitere Aufgabe, die zu neuen Erkenntnissen über die molekularen Mechanismen der endokrinen Zelldifferenzierung beitragen kann, ist die Analyse des endokrinen Pankreas in Abwesenheit von Pax4- und Arx-Genaktivität. Welche endokrine Zellidentität wird von den Vorläuferzellen eingenommen, wenn beide Faktoren, Arx und Pax4, im Pankreas der Maus gleichzeitig inaktiviert werden? Nach den bisherigen Ergebnissen der molekularen Analyse der einzelnen Verlustmutanten sollte man erwarten, dass keine Insulin-, Somatostatin- oder Glukagon-Zellen im Pankreas der doppelmutanten Mäusen auftreten. Überraschenderweise sehen aber die Langerhans´schen Inselzellen in diesen Mäusen morphologisch normal aus. Eine Analyse der endokrinen Hormone zeigte jedoch, dass der Kern der Inselzellen vollständig aus Somatostatin-produzierenden Zellen besteht (Abb. 4). Auch PP-Zellen sind noch vorhanden. Insulin- und Glukagon-Hormone konnten nicht nachgewiesen werden und zeigen, dass die Bildung von β- und α-Zellen beeinträchtigt ist.
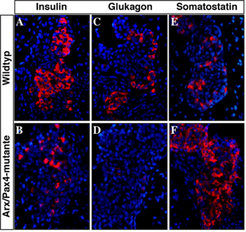
Diese Ergebnisse zeigen eine bislang noch unentdeckte Funktion des Pax4-Gens in der Inhibierung der Somatostatin-Zellidentität [3]. In Analogie zu der Interaktion zwischen Pax4 und Arx zur Prägung der endokrinen β- bzw. α-Zellpopulation kann angenommen werden, dass eine Wechselwirkung zwischen Pax4 und einem noch unbekannten weiteren Faktor X zur Identität der δ-Zellen beiträgt. Dieser Faktor wird dabei von dem Pax4-Gen inhibiert (Abb. 3). Es ist sehr wahrscheinlich, dass dieser Faktor die Bildung der Somatostatin-Zellen fördert, indem die Aktivität von Pax4 gleichzeitig unterbunden wird.
Damit ist die koordinierte Wechselwirkung von Kontrollgenen eine wesentliche Voraussetzung, um die Entwicklung der verschiedenen Hormon-produzierenden Zellen im Pankreas zu gewährleisten. Eine gezielte medikamentöse Beeinflussung dieser Faktoren könnte einen therapeutischen Ansatzpunkt für Diabetes darstellen.



