Keimzellentwicklung im Zebrafisch
Forschungsbericht (importiert) 2004 - Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Beim Zebrafisch handelt es sich um ein Vertebratenmodell, das viele Vorteile und Möglichkeiten bietet. Zebrafisch-Embryonen entwickeln sich außerhalb der Mutter und sind optisch transparent, was den Forschern erlaubt, die Keimzellen im lebenden Organismus zu beobachten. Zudem haben sie eine große Anzahl genetischer Methoden zur Keimzellerforschung zur Verfügung, die es ermöglichen, zum Beispiel spezifische Proteine zu reduzieren oder die Expression von Genen an spezifischen Stellen innerhalb des Embryos zu induzieren.
Auftrennung Keimzellen – somatische Zellen
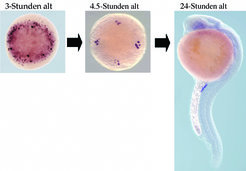
Wie in vielen anderen Organismen entwickeln sich die Keimzellen im Zebrafisch aus einer kleinen embryonalen Zellpopulation, die spezifische RNA (Ribonukleinsäuren) und Proteine erbt, welche im Ei der Mutter abgelagert wurden. Erez Raz und sein Team haben diesen Schritt der Keimzellentwicklung studiert und herausgefunden, dass der einfache Mechanismus in Wirklichkeit aus einer Vielzahl molekularer Ereignisse besteht, die auf der Expression spezifischer RNAs und Proteine in den Keimzellen basieren. Sie konnten zum Beispiel zeigen, dass einige RNA-Moleküle am Anfang nicht ausschließlich in der Region lokalisiert sind, in welcher sich die Keimzellen spezifizieren (Abb. 1, linkes Bild). Eine Kombination aus effizientem Abbau der RNA in somatischen Zellen sowie der Stabilisierung in den Keimzellen resultiert in einer spezifischen Expression dieser Moleküle in den Keimzellen. (Abb. 1, mittleres und rechtes Bild). In ähnlicher Weise konnten die Göttinger zeigen, dass der Mechanismus der differentiellen Stabilität auch für Proteine zutrifft und somit die spezifische Expression von Keimzellfaktoren garantiert wird.
Diese Erkenntnisse hatten wichtige praktische Implikationen in der Erforschung der Keimzellentwicklung. Die RNA- und Proteinregionen, die für die Keimzellen-spezifische Expression verantwortlich sind, konnten charakterisiert und dazu verwendet werden, relevante Proteine spezifisch in den Keimzellen zu lokalisieren.
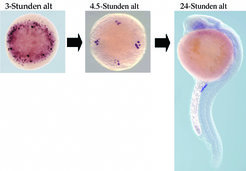 Bild vergrößern
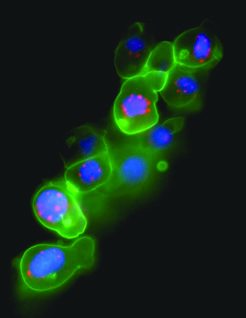
Bild vergrößern Die spezifische Expression eines fluoreszierenden Proteins in den Keimzellen ermöglicht es, dynamische Prozesse innerhalb der Keimzelle zu verfolgen (z. B. durch Beobachtung von zellulären Strukturen) sowie das Verhalten dieser Zellen (z. B. Zellmigration) innerhalb des intakten Embryos zu betrachten (Abb. 2).
Keimzellmigration
Die Tatsache, dass Keimzellen sich sehr früh in der Embryogenese entwickeln, noch bevor somatisches Gewebe der Gonaden entstanden ist, stellt ein interessantes Phänomen dar. Um Spermien und Eizellen zu produzieren, müssen sich die Keimzellen mit somatischem Gewebe verbinden, welches sich erst später entwickelt und oft in großer Entfernung von den spezifizierten Keimzellen. Daher müssen diese dorthin wandern, ein Prozess, der als allgemeines Modell für Zellmigration dienen kann (z.B. in der Organogenese oder in Metastasierungsprozessen). Im Zebrabärbling migrieren die Keimzellen von vier Startpositionen zu einem spezifischen Ziel, der Region, wo sich die Gonaden entwickeln und wo später Spermien und Eizellen produziert werden (Abb. 1).
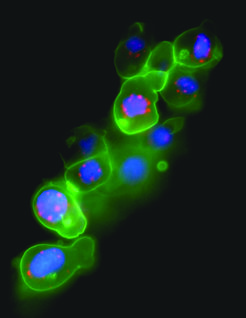 Bild vergrößern
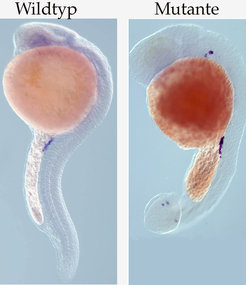
Bild vergrößern Das Studium des Prozesses der Zellmigration in mutanten Embryonen, in welchen die somatischen Zellen sich nicht normal entwickeln, gab wichtige Hinweise auf die Mechanismen, mit denen die wandernden Zellen ihr Ziel erreichen. Eine wichtige Erkenntnis bestand darin, dass die somatischen Zellen die wandernden Zellen mit Signalen zu verschiedenen Geweben hinführen. In Fällen, wo die somatischen Zellen sich nicht normal entwickelten, fehlten teilweise diese Signale. Dies führte dazu, dass die Migration der Keimzellen abnormal verlief und sie plötzlich außerhalb ihrer normalen Positionen lokalisiert waren (Abb. 3). Die Identität dieser Signale konnte durch einen systematischen Screen für Proteine, deren Funktion essenziell ist für normale Keimzellmigration, aufgedeckt werden. In diesem Screen haben die Forscher ein sekretiertes, 100 Aminosäuren langes Protein der Chemokine-Familie identifiziert – SDF1a und sein Rezeptor CXCR4b sind Moleküle, die eine entscheidende Rolle in der zielgerichteten Migration der Keimzellen spielen. Für SDF-1- und CXCR4-Moleküle konnte gezeigt werden, dass sie in einem weiten Spektrum von Zellmigrationsprozessen in der embryonalen Entwicklung und der Homöostase, z. B. Stammzellenmobilisation oder neuronale Zellmigration, involviert sind, sowie in Krankheiten, z. B. Metastasen oder Entzündungen. Interessanterweise ist SDF-1a in Geweben exprimiert, zu denen die Keimzellen wandern. Dies stimmt mit der Idee überein, dass dieses Molekül als Anziehungssignal für die Keimzellen dient. Wenn man die Expression von SDF-1a in den produzierenden somatischen Zellen reduziert oder CXCR4b in den Keimzellen, erhält man einen starken Migrations-Defekt.
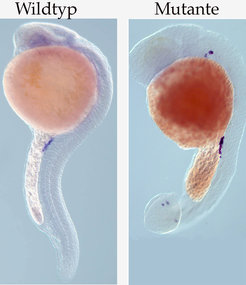 Bild vergrößern
Bild vergrößern Dennoch, Keimzellen die das CXCR4b-Rezeptor-Signal nicht haben, behalten ihre Migrations-Eigenschaft, können jedoch nicht mehr zielgerichtet wandern und erreichen daher ihr Ziel nicht mehr (Abb. 4). Ein wichtiger Punkt: Raz und seine Mitarbeiter konnten zeigen, dass dieselben Moleküle, die die Keimzellen im Zebrabärbling steuern, auch in den Keimzellen von höheren Organismen wie Mäusen und Hühnern eine Rolle spielen.
Signale zwischen Keimzellen und somatischen Zellen
Die somatischen Zellen produzieren also Signale, die wichtig sind, damit die Keimzellen ihr Ziel erreichen: den Ort, wo sie dann Spermien (in Männchen) und Eier (in Weibchen) produzieren. Die Analyse der frühen Stadien der Entwicklung dieser Zellen gab den Göttinger Wissenschaftlern die Möglichkeit, auch die umgekehrte Frage zu stellen und zu bestimmen, ob die Keimzellen die somatischen Zellen in deren Entwicklung beeinflussen. Sie haben herausgefunden, dass die Funktion eines Genprodukts, des RNA-bindenden Proteins Dead end, essenziell für das Überleben der Keimzellen ist. Daher haben sie die Funktion von Dead end in Embryonen eliminiert und so Embryonen generiert, die keine Keimzellen mehr besitzen. Wie erwartet haben sich die Embryonen ohne Keimzellen zu unfruchtbaren erwachsenen Fischen entwickelt.
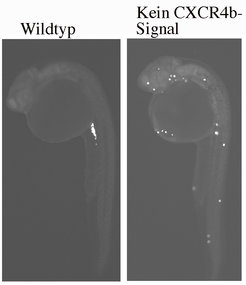 Bild vergrößern
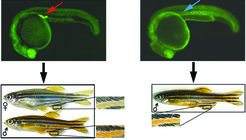
Bild vergrößern Überraschenderweise hatten all diese unfruchtbaren Fische ohne Keimzellen ein männliches Aussehen (Abb. 5). Weitere Analysen haben gezeigt, dass die somatischen Zellen, die sich normalerweise mit den Keimzellen assoziieren, in Abwesenheit von Keimzellen nicht mehr die Gonaden bilden. Durch diese Ergebnisse kamen Raz und seine Mitarbeiter zu dem Schluss, dass die Keimzellen wichtig sind für die somatische Entwicklung der Gonaden und dass dieses Organ essenziell für die Entwicklung zu einem weiblichen Fisch ist. Dieses Resultat zeigt die Wichtigkeit der Keimzellen in der Geschlechtsdifferenzierung bei Fischen auf und kann praktische Konsequenzen für die Fisch-Ökologie haben, da die Beeinflussung der Migration und das Überleben dieser Zellpopulation das Geschlechterverhältnis verändert und somit einen drastischen Einfluss auf die Populationsgröße haben kann.
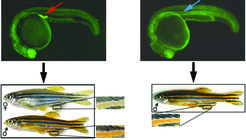 Bild vergrößern
Bild vergrößern Zukunftspläne
Obwohl in den letzten Jahren viel über die Mechanismen der Auftrennung von Keimzellen und somatischen Zellen erforscht wurde, fehlt noch immer das molekulare Verständnis dieser Prozesse. Daher konzentrieren sich die Göttinger Forscher auf die Identifizierung und Analyse weiterer Faktoren, die eine Rolle in diesen Prozessen spielen. Zurzeit „screenen” sie auf Proteine und RNA-Moleküle, die physisch mit bekannten Molekülen interagieren, außerdem führen sie einen Screen durch, um neue Keimzell-exprimierte Gene zu finden. Zusätzlich versuchen die Nachwuchsforscher, den molekularen Mechanismus zu verstehen, der das SDF-1a-Signal in eine zielorientierte Migration der Keimzellen umwandelt. Sie konzentrieren sich dabei auf so genannte Second Messenger (Moleküle, die das Signal weiterleiten) sowie auf bekannte Regulatoren für Zellmorphologie, Verhalten und Migration, wie beispielsweise Calcium-Ionen, Phospholipide und kleine GTPasen der Rho-Familie.
Die Göttinger hoffen, dass ihre Forschungsergebnisse zu einem detaillierten Verständnis dieser wichtigen Aspekte von zellulärem Verhalten in einem In-vivo-Modellsystem (im lebendigen Organismus) führen.
Die molekularen Mechanismen, die Keimzellmigration und Entwicklung steuern, sind größtenteils gleich bei den Keimzellen in verschiedenen Spezies sowie auch zwischen Keimzellen und anderen Zellarten. Diese Tatsache macht das Zebrafisch-Keimzellenmodell zu einem sehr interessanten Forschungsfeld in der Zell- und Entwicklungsbiologie.
Beim Zebrafisch handelt es sich um ein Vertebratenmodell, das viele Vorteile und Möglichkeiten bietet. Zebrafisch-Embryonen entwickeln sich außerhalb der Mutter und sind optisch transparent, was den Forschern erlaubt, die Keimzellen im lebenden Organismus zu beobachten. Zudem haben sie eine große Anzahl genetischer Methoden zur Keimzellerforschung zur Verfügung, die es ermöglichen, zum Beispiel spezifische Proteine zu reduzieren oder die Expression von Genen an spezifischen Stellen innerhalb des Embryos zu induzieren.
Auftrennung Keimzellen – somatische Zellen
Wie in vielen anderen Organismen entwickeln sich die Keimzellen im Zebrafisch aus einer kleinen embryonalen Zellpopulation, die spezifische RNA (Ribonukleinsäuren) und Proteine erbt, welche im Ei der Mutter abgelagert wurden. Erez Raz und sein Team haben diesen Schritt der Keimzellentwicklung studiert und herausgefunden, dass der einfache Mechanismus in Wirklichkeit aus einer Vielzahl molekularer Ereignisse besteht, die auf der Expression spezifischer RNAs und Proteine in den Keimzellen basieren. Sie konnten zum Beispiel zeigen, dass einige RNA-Moleküle am Anfang nicht ausschließlich in der Region lokalisiert sind, in welcher sich die Keimzellen spezifizieren (Abb. 1, linkes Bild). Eine Kombination aus effizientem Abbau der RNA in somatischen Zellen sowie der Stabilisierung in den Keimzellen resultiert in einer spezifischen Expression dieser Moleküle in den Keimzellen. (Abb. 1, mittleres und rechtes Bild). In ähnlicher Weise konnten die Göttinger zeigen, dass der Mechanismus der differentiellen Stabilität auch für Proteine zutrifft und somit die spezifische Expression von Keimzellfaktoren garantiert wird.
Diese Erkenntnisse hatten wichtige praktische Implikationen in der Erforschung der Keimzellentwicklung. Die RNA- und Proteinregionen, die für die Keimzellen-spezifische Expression verantwortlich sind, konnten charakterisiert und dazu verwendet werden, relevante Proteine spezifisch in den Keimzellen zu lokalisieren.
Die spezifische Expression eines fluoreszierenden Proteins in den Keimzellen ermöglicht es, dynamische Prozesse innerhalb der Keimzelle zu verfolgen (z. B. durch Beobachtung von zellulären Strukturen) sowie das Verhalten dieser Zellen (z. B. Zellmigration) innerhalb des intakten Embryos zu betrachten (Abb. 2).
Keimzellmigration
Die Tatsache, dass Keimzellen sich sehr früh in der Embryogenese entwickeln, noch bevor somatisches Gewebe der Gonaden entstanden ist, stellt ein interessantes Phänomen dar. Um Spermien und Eizellen zu produzieren, müssen sich die Keimzellen mit somatischem Gewebe verbinden, welches sich erst später entwickelt und oft in großer Entfernung von den spezifizierten Keimzellen. Daher müssen diese dorthin wandern, ein Prozess, der als allgemeines Modell für Zellmigration dienen kann (z.B. in der Organogenese oder in Metastasierungsprozessen). Im Zebrabärbling migrieren die Keimzellen von vier Startpositionen zu einem spezifischen Ziel, der Region, wo sich die Gonaden entwickeln und wo später Spermien und Eizellen produziert werden (Abb. 1).
Das Studium des Prozesses der Zellmigration in mutanten Embryonen, in welchen die somatischen Zellen sich nicht normal entwickeln, gab wichtige Hinweise auf die Mechanismen, mit denen die wandernden Zellen ihr Ziel erreichen. Eine wichtige Erkenntnis bestand darin, dass die somatischen Zellen die wandernden Zellen mit Signalen zu verschiedenen Geweben hinführen. In Fällen, wo die somatischen Zellen sich nicht normal entwickelten, fehlten teilweise diese Signale. Dies führte dazu, dass die Migration der Keimzellen abnormal verlief und sie plötzlich außerhalb ihrer normalen Positionen lokalisiert waren (Abb. 3). Die Identität dieser Signale konnte durch einen systematischen Screen für Proteine, deren Funktion essenziell ist für normale Keimzellmigration, aufgedeckt werden. In diesem Screen haben die Forscher ein sekretiertes, 100 Aminosäuren langes Protein der Chemokine-Familie identifiziert – SDF1a und sein Rezeptor CXCR4b sind Moleküle, die eine entscheidende Rolle in der zielgerichteten Migration der Keimzellen spielen. Für SDF-1- und CXCR4-Moleküle konnte gezeigt werden, dass sie in einem weiten Spektrum von Zellmigrationsprozessen in der embryonalen Entwicklung und der Homöostase, z. B. Stammzellenmobilisation oder neuronale Zellmigration, involviert sind, sowie in Krankheiten, z. B. Metastasen oder Entzündungen. Interessanterweise ist SDF-1a in Geweben exprimiert, zu denen die Keimzellen wandern. Dies stimmt mit der Idee überein, dass dieses Molekül als Anziehungssignal für die Keimzellen dient. Wenn man die Expression von SDF-1a in den produzierenden somatischen Zellen reduziert oder CXCR4b in den Keimzellen, erhält man einen starken Migrations-Defekt.
Dennoch, Keimzellen die das CXCR4b-Rezeptor-Signal nicht haben, behalten ihre Migrations-Eigenschaft, können jedoch nicht mehr zielgerichtet wandern und erreichen daher ihr Ziel nicht mehr (Abb. 4). Ein wichtiger Punkt: Raz und seine Mitarbeiter konnten zeigen, dass dieselben Moleküle, die die Keimzellen im Zebrabärbling steuern, auch in den Keimzellen von höheren Organismen wie Mäusen und Hühnern eine Rolle spielen.
Signale zwischen Keimzellen und somatischen Zellen
Die somatischen Zellen produzieren also Signale, die wichtig sind, damit die Keimzellen ihr Ziel erreichen: den Ort, wo sie dann Spermien (in Männchen) und Eier (in Weibchen) produzieren. Die Analyse der frühen Stadien der Entwicklung dieser Zellen gab den Göttinger Wissenschaftlern die Möglichkeit, auch die umgekehrte Frage zu stellen und zu bestimmen, ob die Keimzellen die somatischen Zellen in deren Entwicklung beeinflussen. Sie haben herausgefunden, dass die Funktion eines Genprodukts, des RNA-bindenden Proteins Dead end, essenziell für das Überleben der Keimzellen ist. Daher haben sie die Funktion von Dead end in Embryonen eliminiert und so Embryonen generiert, die keine Keimzellen mehr besitzen. Wie erwartet haben sich die Embryonen ohne Keimzellen zu unfruchtbaren erwachsenen Fischen entwickelt.

Überraschenderweise hatten all diese unfruchtbaren Fische ohne Keimzellen ein männliches Aussehen (Abb. 5). Weitere Analysen haben gezeigt, dass die somatischen Zellen, die sich normalerweise mit den Keimzellen assoziieren, in Abwesenheit von Keimzellen nicht mehr die Gonaden bilden. Durch diese Ergebnisse kamen Raz und seine Mitarbeiter zu dem Schluss, dass die Keimzellen wichtig sind für die somatische Entwicklung der Gonaden und dass dieses Organ essenziell für die Entwicklung zu einem weiblichen Fisch ist. Dieses Resultat zeigt die Wichtigkeit der Keimzellen in der Geschlechtsdifferenzierung bei Fischen auf und kann praktische Konsequenzen für die Fisch-Ökologie haben, da die Beeinflussung der Migration und das Überleben dieser Zellpopulation das Geschlechterverhältnis verändert und somit einen drastischen Einfluss auf die Populationsgröße haben kann.
Zukunftspläne
Obwohl in den letzten Jahren viel über die Mechanismen der Auftrennung von Keimzellen und somatischen Zellen erforscht wurde, fehlt noch immer das molekulare Verständnis dieser Prozesse. Daher konzentrieren sich die Göttinger Forscher auf die Identifizierung und Analyse weiterer Faktoren, die eine Rolle in diesen Prozessen spielen. Zurzeit „screenen” sie auf Proteine und RNA-Moleküle, die physisch mit bekannten Molekülen interagieren, außerdem führen sie einen Screen durch, um neue Keimzell-exprimierte Gene zu finden. Zusätzlich versuchen die Nachwuchsforscher, den molekularen Mechanismus zu verstehen, der das SDF-1a-Signal in eine zielorientierte Migration der Keimzellen umwandelt. Sie konzentrieren sich dabei auf so genannte Second Messenger (Moleküle, die das Signal weiterleiten) sowie auf bekannte Regulatoren für Zellmorphologie, Verhalten und Migration, wie beispielsweise Calcium-Ionen, Phospholipide und kleine GTPasen der Rho-Familie.
Die Göttinger hoffen, dass ihre Forschungsergebnisse zu einem detaillierten Verständnis dieser wichtigen Aspekte von zellulärem Verhalten in einem In-vivo-Modellsystem (im lebendigen Organismus) führen.
Die molekularen Mechanismen, die Keimzellmigration und Entwicklung steuern, sind größtenteils gleich bei den Keimzellen in verschiedenen Spezies sowie auch zwischen Keimzellen und anderen Zellarten. Diese Tatsache macht das Zebrafisch-Keimzellenmodell zu einem sehr interessanten Forschungsfeld in der Zell- und Entwicklungsbiologie.




