Optische Nanoskopie in den Neurowissenschaften
Optische Nanoskopie
Die Lichtmikroskopie ist seit jeher ein beliebtes Instrument, um kleinste Strukturen sichtbar zu machen und hat vor allem in den Lebenswissenschaften eine enorme Bedeutung. Mit ihrer Hilfe ist es möglich, lebende Zellen oder sogar kleine Organismen im Detail zu untersuchen. Dafür werden zunächst die zu untersuchenden Proteinstrukturen mit kleinen, fluoreszierenden Farbstoffen markiert, um dann kontrastreich und ohne störenden Hintergrund mit dem Lichtmikroskop dargestellt zu werden. Im Prinzip kann mit dieser Methode jede beliebige Struktur in einer Zelle sichtbar gemacht werden, wie z.B. das Zytoskelett, der Zellkern oder wichtige funktionelle Einheiten wie Rezeptoren. Die räumliche Auflösung ist allerdings in der herkömmlichen Lichtmikroskopie begrenzt; feinste Strukturen, die für die Funktion einer Zelle von enormer Bedeutung sind, können so nicht dargestellt werden. Ein Beispiel hierfür sind die Kernporen, ein Proteinkomplex, welcher den Durchlass für Moleküle in und aus dem Zellkern erlaubt. Diese können auf Grund ihrer geringen Größe nicht mit dem Lichtmikroskop ausreichend aufgelöst werden.
In den letzten Jahren gelang der Durchbruch mit Hilfe einer Methode, welche die Auflösungsgrenze vollständig umgeht und somit eine kleine Revolution in der Lichtmikroskopie auslöste: in den 90’er Jahren entwickelte Prof. Dr. Stefan W. Hell (Max-Planck-Institut für Biophysikalische Chemie, Göttingen) die STED Mikroskopie, mit der zum ersten Mal mit einem Fernfeld-Lichtmikroskop Strukturen unterhalb des Beugungslimits dargestellt werden konnten. Die STED Mikroskopie verwendet dafür zusätzlich zum Anregungslicht einen zweiten Lichtstrahl, der einen Teil der Fluoreszenz durch stimulierte Emission ausschaltet (engl. Stimulated Emission Depletion). Inzwischen gibt es weitere Methoden, welche die Auflösungsgrenze umgehen und unter dem Namen „Nanoskopie“ oder „Superauflösung“ (engl. superresolution) zusammengefasst werden.
Neurowissenschaften — ein ertragreiches und herausforderndes Gebiet für STED Mikroskopie
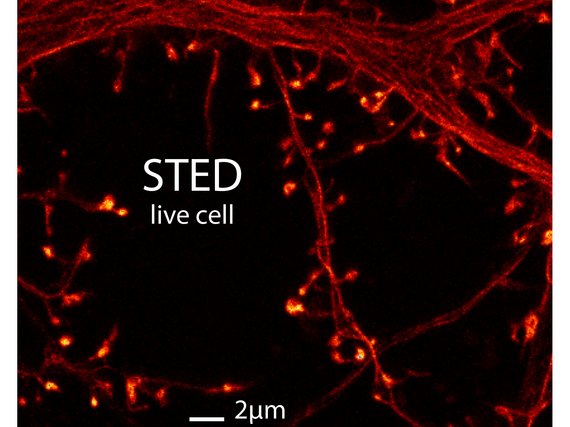
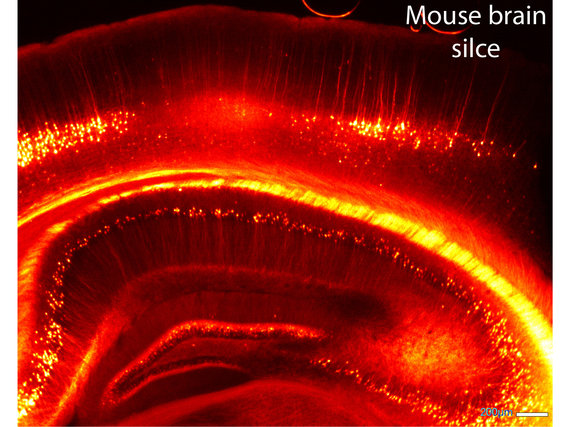
Die Verbindungsstellen zwischen Nervenzellen, genannt Synapsen, bilden im Gehirn eine wesentliche Schaltstelle, an der Informationen weitergegeben, bzw. verarbeitet werden. Hierbei unterscheidet man zwei Arten von Synapsen: exzitatorische, welche stimulierend bzw. erregend auf die Nachbarzelle wirken oder inhibitorische, welche die Zielzelle hemmen. Exzitatorische Synapsen bilden sich häufig mit kleinen, dendritischen Ausstülpungen, den so genannten Dornfortsätzen (engl. Spines). Die Spines bilden das kleinste bekannte, funktionelle Kompartiment im Zentralnervensystem mit einer sehr dünnen, oft unter hundert Nanometer dicken Verbindung zum Dendriten (ein Teil der Nervenzelle). Die winzige Größe von Synapsen erschwert zwar die konventionelle Bildgebung, macht sie aber zugleich zu einem idealen Untersuchungsobjekt für die STED Mikroskopie. Da eine Nervenzelle gleichzeitig sehr viele Kontakte bildet und für eine volle Funktionalität auch möglichst alle diese Kontakte erhalten bleiben sollen, erfolgt die Untersuchung am besten direkt im Gewebe, also im intakten Verbund mit den umliegenden Nervenzellen. Von allen Nanoskopie-Methoden ist die STED Mikroskopie besonders für die Untersuchung von lebenden Geweben geeignet. Die Datenaufnahme ist relativ schnell und somit auch für dynamische Prozesse geeignet. Aufnahmen im Gewebe mit einer Eindringtiefe bis zu ~ 100 Mikrometern wurden bereits gezeigt und es können im Prinzip alle herkömmlichen Fluoreszenzmarkierungen verwendet werden.
Wir haben in den letzten Jahren bereits die STED Mikroskopie benutzt, um dendritische Spines im lebenden Gewebe abzubilden. Die Dynamik, die wir dabei beobachten konnten, lässt darauf schließen, dass kurzfristige Strukturveränderungen während der normalen Aktivität des Zentralnervensystems stattfinden und als Reaktion auf sich ändernde äußere Einflüsse oder endogener Bedingungen zu verstehen sind. In unserer Arbeitsgruppe wollen wir uns auch in Zukunft weiter mit den morphologischen Veränderungen im Gehirn beschäftigen und so zum Verständnis plastischer Prozesse auf Synapsenebene beitragen.
Medienbeiträge
Deutschlandfunk: Dem Gehirn beim Lernen zusehen
Life Science Standort Niedersachsen, Video mit Blick in unser Labor.